Axit clohidric | HCl (Là gì, TCHH, Ứng dụng, Mạnh hay yếu, Mindmap)
 5/1/2024
5/1/2024
Tổng hợp kiến thức về axit clohidric (HCl): Cấu tạo phân tử, tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp học sinh ôn tập, bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
Axit clohidric là gì?
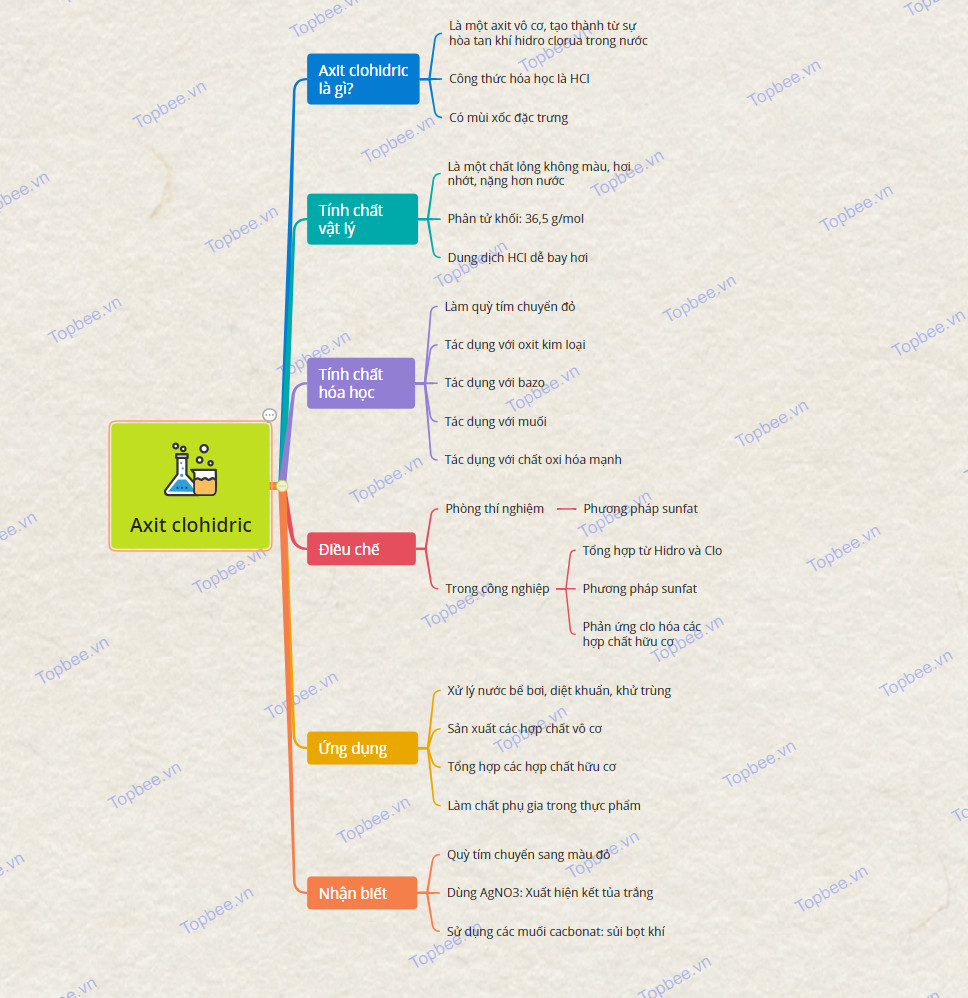
- Khái niệm: Là một axit vô cơ, tạo thành từ sự hòa tan khí hidro clorua trong nước.
- Cấu tạo phân tử: gồm liên kết đơn cộng hóa trị giữa một nguyên tử clo và một nguyên tử hidro

+ Công thức hóa học là HCl
- Axit clohidric có mùi xốc đặc trưng
Tính chất vật lý
+ Ở điều kiện thường, axit clohidric là một chất lỏng không màu, trong suốt hoặc vàng nhạt (do lẫn hợp chất), hơi nhớt, nặng hơn nước
+ HCl đậm đặc nhất có nồng độ tối đa là 40% có màu vàng ngả xanh lá.
+ Phân tử khối: 36,5 g/mol.
+ Dung dịch HCl dễ bay hơi.
+ Nhiệt độ nóng chảy: -27,32°C (247 K) dung dịch 38%.
+ Nhiệt độ sôi: 110°C (383 K), dung dịch 20,2%; 48°C (321 K), dung dịch 38%.
Tính chất hóa học
- Axit clohidric làm quỳ tím chuyển đỏ.
- Tính oxi hóa: Tác dụng với kim loại trước Hidro, tạo thành muối và giải phóng khí H2.
Fe + 2HCl → FeCl2 + H2
Lưu ý: Chì Pb không tan trong dung dịch HCl.
- HCl tác dụng với oxit kim loại tạo ra muối mới và nước.
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
Khi đó, kim loại vẫn giữ nguyên hóa trị
- Tác dụng với bazơ tạo ra muối và nước, kim loại giữ nguyên hóa trị.
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
- Axit clohidric tác dụng với muối tạo ra muối mới và axit mới.
Na2CO3 + 2HCl → 2NaBr + H2O + CO2
AgNO3 + HCl → AgCl + HNO3
- Tính khử: Khi dung dịch HCl đặc tác dụng với các chất oxi hóa mạnh như: KMnO4, K2Cr2O7, MnO2, KClO3, ... thì HCl bị oxi hóa thành
Cl2 theo phương trình:
Mn+4O2 + 4HCl-1 → Mn+2Cl2 + Cl20 + 2H2O
2KMn+7O4 + 16H+1Cl → 2KCl + 2Mn+2Cl2 + 5Cl20 + 6H2O.
- HCl không tác dụng với chất nào:
+ Kim loại đứng sau H trong dãy điện hóa như Cu, Ag, Au,….
+ Muối không tan có gốc CO3 và PO4 (trừ K2CO3, Na2CO3, K3PO4 và Na3PO4)
+ HCl không tác dụng với axit, phi kim, oxit phi kim
Axit clohidric là axit mạnh hay yếu?
HCl là một hợp chất hóa học vô cơ có tính axit mạnh nhất và phổ biến nhất trong tự nhiên, có khả năng ăn mòn cao và cháy nổ
khi tiếp xúc với một số hợp chất khác.
Cách nhận biết
+ Dùng quỳ tím: Quỳ tím chuyển sang màu đỏ.
+ Dùng dung dịch AgNO3: Xuất hiện kết tủa trắng không tan
HCl + AgNO3 → AgCl↓ + HNO3
+ Sử dụng kim loại như Zn hoặc Fe …: Kim loại tan dần và có khí không màu thoát ra.
Fe + 2HCl → FeCl2 + H2↑
+ Dùng muối cacbonat (như Na2CO3): có hiện tượng sủi bọt khí
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Phương pháp điều chế
*Trong phòng thí nghiệm: Dùng phương pháp sunfat:
NaCl (r) + H2SO4 (đ) → NaHSO4 + HCl (< 2500C)
2NaCl (r) + H2SO4 (đ) → Na2SO4 + 2HCl (> 4000C)
*Trong công nghiệp:
+ Tổng hợp từ Hidro và Clo
H2 + Cl2 → 2HCl (đun nóng)
- Phương pháp sunfat (với t0 ≥ 4000C):
2NaCl(r) + H2SO4 (đ)⟶ Na2SO4 + 2HCl↑
- Từ phản ứng clo hóa các hợp chất hữu cơ:
CH4 + Cl2 ⟶ CH3Cl + HCl
Ứng dụng
- Ứng dụng trong xử lý nước bơi để khử trùng, diệt khuẩn, cân bằng nồng độ pH,…
- HCl nồng độ 18% dùng tẩy gỉ thép hiệu quả trước khi cán, mạ điện,….
- Sản xuất các hợp chất vô cơ: hóa chất xử lý nước thải, muối clorua,..
- Tổng hợp các hợp chất hữu cơ như vinyl clorua, diclorometa, than hoạt tính, polycacbonat, axit ascobic, một số loại dược phẩm,…
- Dùng trong xử lý da thuộc, vệ sinh nhà cửa
- Tạo hỗn hợp nước cường toan với HNO3 (hòa tan vàng, bạch kim).
- Có tác dụng là chất phụ gia thực phẩm
Sử dụng Axit clohidric đúng cách
*Quy tắc sử dụng Axit clohidric đúng cách
– Làm giảm nồng độ Ph , sử dụng kèm clorua 70%
– Sử dụng liều lượng: 1 – 4 lít / 100m3 / lần .
– Chú ý đổ axit vào nước, không làm quá trình ngược lại
– Tránh tiếp xúc trực tiếp, khi sử dụng cần có các thiết bị bảo hộ.
– Không được uống, hít vào.
– Không được để axít chảy vào hệ thống thoát nước…
– Nếu có sự cố rò rỉ, thì có thể làm giảm thiểu nguy hại bằng cách trung hòa với dung dịch NaOH loãng, hoặc đá vôi, Na2CO3.
*Cách bảo quản Axit clohidric
+ Đặt nơi khô ráo, tránh ánh nắng chiếu trực tiếp vào, bồn chứa bằng nhựa, không đựng trong bồn chứa được làm bằng chất liệu kim loại.
+ Tránh để HCl tiếp xúc gần các kim loại
+ Đặt các biển báo, nội quy,.. để tránh nguy cơ gây nên đổ vỡ, rò rỉ axit ra ngoài
+ Không để chung HCl với các chất dễ cháy, các chất oxi hóa như Axit Nitric, axit photphoric, các hợp chất Clorat,...
Sơ đồ tư duy về Axit clohidric