Axit hydroiodic | HI (Là gì, TCHH, Ứng dụng, Mạnh hay yếu, Mindmap)
 10/1/2024
10/1/2024
Tổng hợp kiến thức về axit hydroiodic (HI) : Cấu tạo phân tử, Tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp học sinh ôn tập, bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
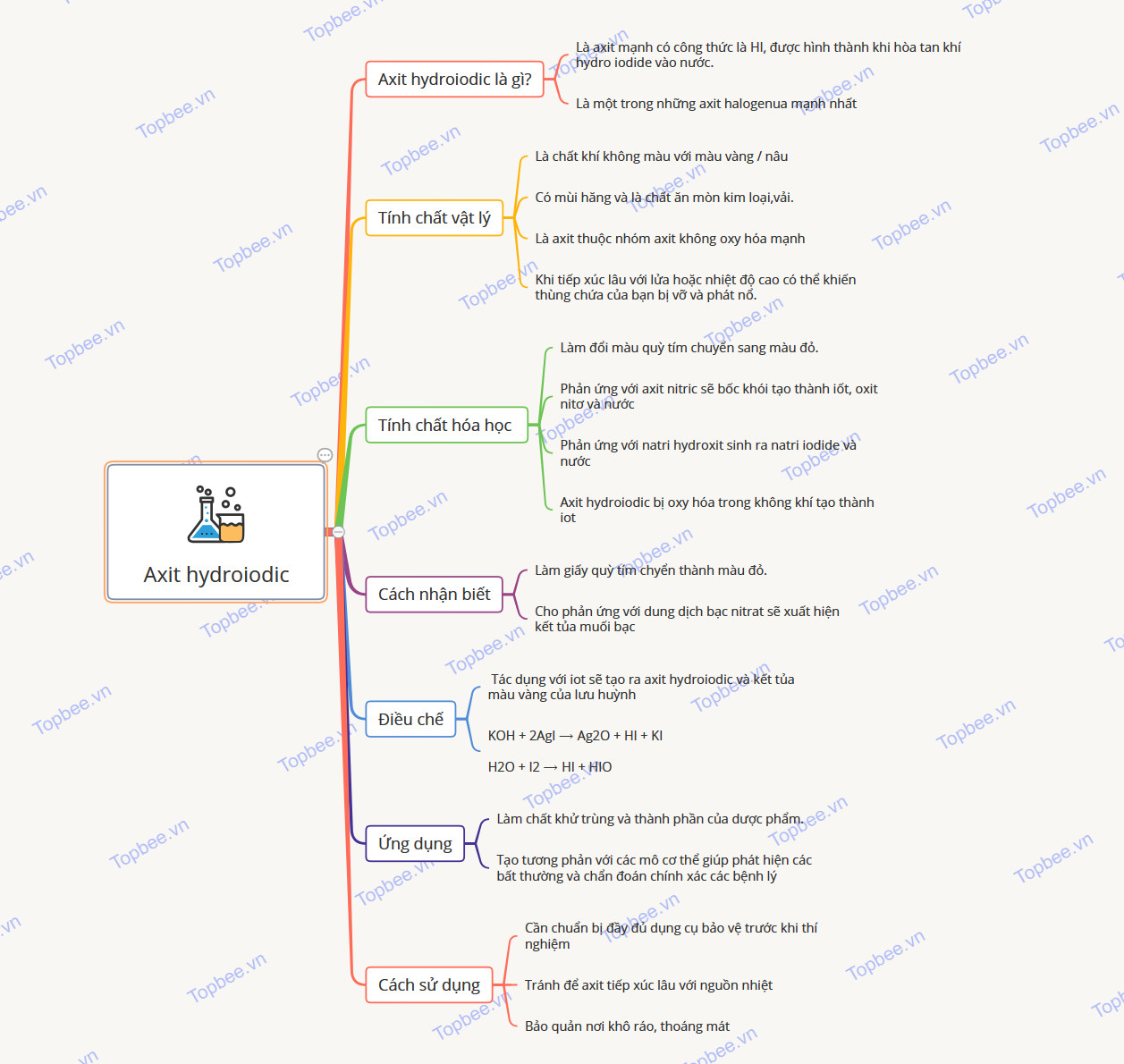
Axit hydroiodic là gì?
- Khái niệm: Axit hydroiodic là axit mạnh có công thức là HI, được hình thành khi hòa tan khí hydro iodide vào nước. Còn có tên gọi khác là axit Iothidric. Đây là một trong những axit halogenua mạnh nhất trong tất cả các axit halogen phổ biến do độ ổn định cao của cơ sở liên hợp tương ứng của nó
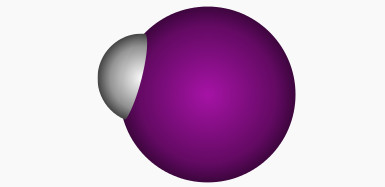
- Cấu tạo phân tử:
Tính chất vật lý của Axit hydroiodic
- Là axit thuộc nhóm axit không oxy hóa mạnh (cùng với axit hydrochloric và axit hydrobromic).
- Axit hydroiodic có tính axit mạnh và có tính chất gần giống với các axit halogen mạnh hơn so với HCl và HBr, và yếu hơn so với HF.
- Khi phản ứng với các chất bazơ sẽ dễ dàng tách proton (H+) ra khỏi phân tử
- Có giá trị pKa nhỏ hơn -2 hoặc giá trị pH nhỏ hơn 2.
- Nó có mùi hăng và là chất ăn mòn kim loại,vải.
- Là chất khí không màu với màu vàng / nâu khi ở dạng khan (hydro iodua).
- Khi tiếp xúc lâu với lửa hoặc nhiệt độ cao có thể khiến thùng chứa của bạn bị vỡ và phát nổ.
Tính chất hóa học của Axit hydroiodic
- Khi phản ứng với axit nitric sẽ bốc khói tạo thành iốt, oxit nitơ và nước như phương trình hóa học sau:
2HNO3 + 6HI → 2NO + 3I2 + 4H2O
- Phản ứng với natri hydroxit sinh ra natri iodide và nước:
HI + NaOH → NaI + H2O
- Axit hydroiodic bị oxy hóa trong không khí tạo thành I2:
4HI + O2 → 2H2O + 2I2
HI + I2 → HI3
- Ngoài ra HI còn phản ứng cộng với anken:
HI + H2C=CH2 → H3CCH2I
Cách nhận biết axit hydroiodic (HI)
- Làm quỳ tím chuyển sang màu đỏ
- Cho phản ứng với dung dịch AgNO3 sẽ xuất hiện kết tủa muối bạc halogenua như phương trình sau:
HCl + AgNO3 → AgCl (↓ trắng) + HNO3
HBr + AgNO3 → AgBr (↓ vàng) + HNO3
HI + AgNO3 → AgI (↓ vàng đậm) + HNO3
Phương pháp điều chế
- Cho axit hydro sulfua tác dụng với iot sẽ tạo ra axit hydroiodic và kết tủa màu vàng của lưu huỳnh:
H2S + I2 ⟶ 2HI + S
- Dưới đây là một số phương trình phản ứng điều chế HI:
KOH + 2AgI ⟶ Ag2O + HI + KI
H2O + I2 ⟶ HI + HIO
16H2O + 4S + 3I2Cl6 ⟶ 4H2SO4 + 18HCl + 6HI
2H2O + I2 + SO2 ⟶ H2SO4 + 2HI
H2O + HfI4 ⟶ 2HI + HfI2O
3H2O + 3I2 + Na2N2O2 ⟶ 6HI + NaNO2 + NaNO3
Ứng dụng
- Nó được làm chất khử trùng và thành phần của dược phẩm.
- Trong tổng hợp hữu cơ và vô cơ nó được sử dụng như một trong những nguồn iốt chính .
- Giúp các bác sĩ quan sát rõ nét hơn các cấu trúc bên trong cơ thể, phát hiện các bất thường và chẩn đoán chính xác các bệnh lý khi xét nghiệm chụp X-quang, chụp cắt lớp vi tính và chụp mạch máu.
Sử dụng Axit hydroiodic đúng cách
- Quy tắc sử dụng Axit hydroiodic đúng cách
+ Khi sử dụng axit hydroiodic cần chuẩn bị đầy đủ dụng cụ bảo vệ như găng tay, mũ, quần áo dài tay, …
+ Trong trường hợp bị dây vào da hoặc mắt hãy rửa ngay bằng nước sạch. Để an toàn hãy đến trạm y tế gần nhất.
+ Trước khi sử dụng Axit hydroiodic bạn nên thông báo cho bác sĩ về tình trạng sức khỏe hiện tại và lịch sử dị ứng của mình.
- Cách bảo quản Axit hydro sulfua
+ Bảo quản nơi khô ráo, thoáng mát và đậy chặt nắp tránh ánh nắng trực tiếp.
Sơ đồ tư duy về Axit hydroiodic