Axit nitric | HNO3 (Là gì, TCHH, Ứng dụng, Mạnh hay yếu, Mindmap)
 6/1/2024
6/1/2024
Tổng hợp kiến thức về axit nitric (HNO3): Cấu tạo phân tử, tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp học sinh ôn tập, bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
Axit nitric là gì?
- Khái niệm: Axit nitric là một axit độc, hình thành từ những cơn mưa kèm sấm sét, gây nên hiện tượng mưa axit.
- Cấu tạo phân tử: Gồm một nguyên tử nitơ liên kết với hai nguyên tử oxi bằng liên kết ba và một nguyên tử oxi liên kết với một nguyên tử
hidro thành nhóm chức axit (-OH)
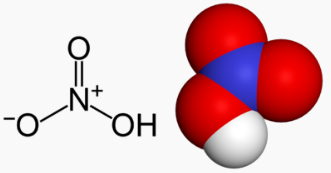
+ Công thức cấu tạo: HNO3
- Axit nitric có mùi khó chịu.
Tính chất vật lý
- HNO3 tinh khiết là chất lỏng không màu và bốc khói mạnh ở môi trường không khí ẩm. Ngoài ra, nó còn ở dạng khí không màu.
- Trong tự nhiên sẽ có màu hơi vàng do sự tích tụ của các nitơ oxit
- Axit nitric tan nhiều trong nước với bất kỳ tỉ lệ nào
- Phân tử khối: 63g/mol
- Nhiệt độ nóng chảy: −42°C (231K; −44°F)
- Nhiệt độ sôi: 83°C
- Khi sôi trong ánh sáng, kể cả tại nhiệt độ phòng, sẽ xảy ra một sự phân hủy một phần tạo ra nitơ oxit
Tính chất hóa học
- Làm đổi màu quỳ tím thành màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tác dụng với kim loại:
+ Phản ứng mãnh liệt với nhiều kim loại và phản ứng có thể gây nổ tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO2 + H2O ( to)
Ví dụ:
Cu + 4HNO3 (đặc) → Cu(NO3)2 + 2NO2↑ + 2H2O
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Ví dụ:
3Cu + 8HNO3 (loãng) → 3Cu(NO3)2 + 2NO↑ + 4H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Ví dụ:
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
+ Ngoại trừ các kim loại quý (Au, Pt) và một số hợp kim
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen)
+ Với axit nitric đặc sẽ tạo nitơ dioxit
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
+ Với axit loãng và nước, oxit của phi kim tạo nitơ oxit.
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
- Tác dụng với hợp chất hữu cơ: HNO3 có khả năng phản ứng với nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
Axit nitric là axit mạnh hay yếu?
Acid nitric là một axit một nấc phân li bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hidrat
HNO3 + H2O → H3O+ + NO3−
Nên nó là một axit mạnh, độc và ăn mòn cao.
Cách nhận biết
- Dùng quỳ tím: giấy quỳ chuyển đỏ.
- Dùng kim loại Cu:
+ Dung dịch thu được có màu xanh, thoát ra khí không màu thoát ra
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO↑ + 4H2O
+ Khí thoát ra tiếp xúc không khí chuyển màu nâu đỏ:
2NO(không màu) + O2 → 2NO2 (nâu đỏ)
Phương pháp điều chế
Phòng thí nghiệm
+ Cho muối natri nitrat tác dụng với dung dịch axit sunfuric đặc nóng.
+ Chưng cất hỗn hợp này ở nhiệt độ 83 độ C.
+ Thu được chất kết tinh màu trắng.
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
- Phương pháp này chỉ sản xuất được một lượng nhỏ HNO3.
Trong công nghiệp
+ Cô đặc HNO3 loãng với hỗn hợp azeotropic 32% nước đến nồng độ 68%.
+ Chưng cất axit HNO3 với axit sunfuric H2SO4. Chất khử H2SO4 sẽ hấp thụ lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O→ 4HNO3
Ứng dụng
- Sử dụng phổ biến trong điều chế thuốc nổ như trinitrotoluen (TNT), nitroglycerin, cyclotrimethylenetrinitramin (RDX)
- Sản xuất phân bón, phân đạm, các muối nitrat như KNO3, Ca(NO3)2,…
- Dùng để tẩy rửa các đường ống, tẩy rửa bề mặt kim loại, xử lý nước, loại bỏ tạp chất, cân bằng pH của nước,..
- Ứng dụng trong xi mạ, luyện kim vì phản ứng hầu hết với các kim loại
- Làm thuốc tẩy màu để phân biệt morphine và heroin.
- Kết hợp với axit clohidric tạo thành dung dịch nước cường toan, hòa tan được cả vàng và bạch kim.
- Chế tạo thuốc nhuộm vải, len, sợi,…
- Làm chất xúc tác, làm thuốc thử, chất khử màu để phân biệt nhiều chất hóa học.
Sử dụng Axit nitric đúng cách
Quy tắc sử dụng Axit nitric đúng cách
– Mặc đồ bảo hộ an toàn khi làm việc quần áo dài tay, kính mắt, găng tay, khẩu trang, mũ, giày,….
– Nơi làm việc đảm bảo thông thoáng, sạch sẽ, tránh xa các vật dụng dễ cháy nổ.
– Khi pha loãng axit, tuyệt đối không đổ nước vào bên trong dung dịch axit nitric mà phải cho axit vào nước.
Cách bảo quản Axit nitric
– Thùng chứa axit phải được đậy kín nắp. Và vật liệu làm thùng phải là chất liệu nhựa thay vì kim loại vì HNO3 không tác dụng với chất liệu này.
– Nền nhà kho phải được làm bằng vật liệu chống được axit.
– Bảo quản axit nitric trong khu vực an toàn và tránh xa các vật liệu không tương thích. Ví dụ như các hợp chất hữu cơ, rượu, hơi ẩm hoặc kim loại.
– Khu vực bảo quản phải đảm bảo thông thoáng, tránh xa các nguồn phát nhiệt và ánh nắng mặt trời.
Sơ đồ tư duy về Axit nitric