Axit propionic | C2H5COOH (Là gì, TCHH, Ứng dụng, Mạnh hay yếu, Mindmap)
 6/1/2024
6/1/2024
Tổng hợp kiến thức về propionic (C2H5COOH) : Cấu tạo phân tử, Tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp học sinh ôn tập, bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
Axit propionic là gì?
- Khái niệm: là một axit hữu cơ có công thức hóa học là CH3CH2COOH. Khi ở trạng thái tinh khiết trong điều kiện thông thường axit
propionic là một chất lỏng không màu, có tính ăn mòn và có mùi hăng, được dùng làm chất bảo quản,..
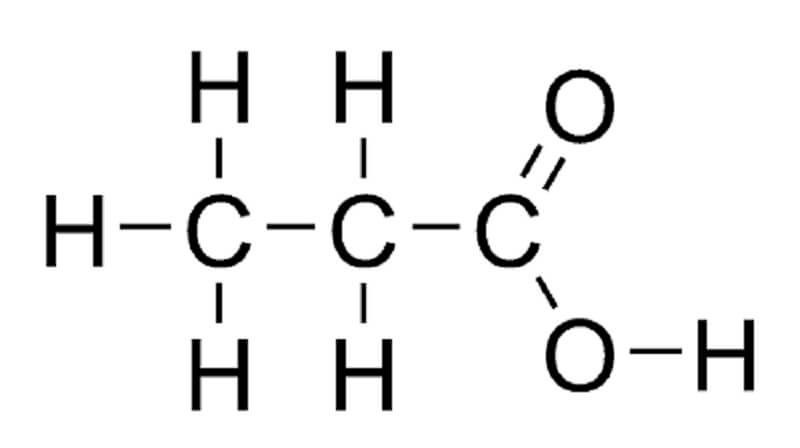
- Cấu tạo phân tử:
Tính chất vật lý của axit propionic
- Acid propionic có các tính chất vật lý trung gian giữa các tính chất của các axit carboxylic nhỏ hơn như axit formic và axit axetic, với
các acid béo lớn hơn.
- Ở trạng thái tự nhiên nó tồn tại dưới dạng chất lỏng, không màu.
- Có thể hòa tan trong môi trường nước.
- Nhiệt độ nóng chảy: -21 độ C ứng với 252 K.
- Nhiệt độ sôi: 141 độ C ứng với 414 K.
- Độ axit: pKa = 4,88.
- Tỷ trọng: 0,99 g/cm3.
- Về tính chất vật lý: Acid formic, axit axetic < axit propionic < axit béo.
Tính chất hóa học của Axit propionic
- Phản ứng este:
C2H5COOH + CH3OH → C2H5COOCH3 + H20
- Tác dụng với dung dịch kiềm:
C2H5COOH + NaOH → C2H5COONa + H2O
- Tác dụng với các muối:
Na2CO3 + 2C2H5COOH -> H2O + CO2 + 2C2H5COONa
NaHCO3 + C2H5COOH -> H2O + CO2 +C2H5COONa
- Tham gia phản ứng halogen hóa với brom khi có tác nhân xúc tác là PBr3.
CH3CH2COOH + Br2 → CH3CHBrCOOH
Cl2 + CH3CH2COOH -> HCl + CH3CHClCOOH
Axit propionic là axit mạnh hay yếu?
Axit propionic có tính axit yếu do phân tử có chứa nhóm chức -COOH (nhóm chức của axit cacboxylic) thuộc vào axit hữu cơ.
Phương pháp điều chế
- Axit Propionic được sản xuất từ phản ứng oxi hoá của Propionandehit bằng không khí và được thực hiện ở 40 – 50 độ C:
CH3CH2CHO + 1/2O2 -> CH3CH2COOH
- Ngoài ra Axit Propionic còn được điều chế từ Metan và phải trải qua quá trình sau:
1. CH4 + Cl2 → CH3Cl + HCl
2. CH2Cl + 2Na + C3H7Cl → C4H10 + 2NaCl
3. C4H10 → C3H6 + CH4
4. C3H6 + H2O → C3H7OH
Ứng dụng
- Ngăn cản sự phát triển của vi khuẩn và nấm mốc nên đã được sử dụng làm chất bảo quản cho thực phẩm dành cho con người và
gia súc.
- Không chỉ vậy mà còn làm thay đổi sợi xenlulozo tổng hợp.
- Là chất đóng góp vào sản xuất một số thuốc trừ sâu và dược phẩm.
- Các este của axid propionic đôi lúc còn được dùng làm dung môi hay các chất tạo mùi nhân tạo.
Mức độ an toàn của axit propionic
+ Khi axit propionic tiếp xúc với axid đậm đặc sẽ sinh ra bỏng hóa chất rất nguy hiểm
+ Chỉ với một lượng nhỏ axid propionic dẫn đến các vết loét thực quản và dạ dày do tiêu thụ chất có tính ăn mòn.
+ Ở người, trong cơ thể của chúng ta chất này bị oxi nhanh chóng và đào thải ra bên ngoài dưới dạng carbon dioxide theo chu trình
Krebs. Acid Propionic không tích lũy sinh học.
Sử dụng Axit propionic đúng cách
Khi sử dụng axit propionic chúng ta cần chú ý những điều sau:
- Trước khi tiếp xúc với hóa chất này ta phải chuẩn bị đầy đủ đồ bảo hộ để tránh chất bắn lên người gây thương tích không mong
muốn.
- Trong trường hợp bị bắn hóa chất lên người hãy thực hiện các biện pháp sơ cứu rồi đến ngay cơ sở y tế gần nhất để có các
hướng
xử trí tiếp theo.
- Không nên để axit propionic tiếp xúc với nơi có nhiệt độ cao hay hóa chất dễ cháy nổ,... vì chất này rất dễ cháy.
- Nên bảo quản ở nơi khô ráo, thoáng mát, không để những nơi ẩm ướt.
Sơ đồ tư duy của axit propionic