

Bari | Ba (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 20/12/2023
20/12/2023
Bài viết tìm hiểu về Bari (Ba) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Bari (Ba): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
Bari tồn tại ở đâu?
- Bari là một nguyên tố hoá học có ký hiệu là Ba và số hiệu nguyên tử là 56. Bari là kim loại kiềm thổ nằm ở nhóm 2 của bảng tuần hoàn.
- Trong tự nhiên, không thể tìm được Bari dưới dạng nguyên tố tự do vì nó có khả năng phản ứng hóa học rất cao. Một số khoáng vật phổ biến của Bari trong tự nhiên:
+ barit (bari sulfat, BaSO4)
+ witherit (bari carbonat, BaCO3)
- Cả hai chất BaSO4 và BaCO3 đều không tan trong nước.
Cấu tạo nguyên tử của Bari
- Barium có số hiệu nguyên tử là 56
- Cấu hình e: 1s22s22p63s23p63d104s24p64d105s25p66s2
+ Ba thuộc ô số 56 (do Z = 56)
+ Chu kì 6 (do có 6 lớp electron)
+ Nhóm IIA (do có 2 electron hóa trị, nguyên tố s).
+ Ba là kim loại kiềm thổ.
+ Khi hình thành liên kết hóa học, Ba có xu hướng nhường 2 electron để đạt cấu hình bền vững của khí hiếm gần nó nhất là Xe.
Tính chất vật lý
- Kim loại kiềm thổ có màu trắng bạc, dẻo, rèn được.
- Khi bị oxy hóa trong không khí màu trắng bạc của kim loại bari biến mất nhanh chóng tạo lớp oxide màu xám sậm.
- Bari có khả năng dẫn điện tốt và có khối lượng riêng là 3,6 g/cm3; nhiệt độ nóng chảy là 7270C và sôi ở 18600C.
Tính chất hóa học
- Bari là kim loại kiềm thổ có tính khử mạnh.
Ba → Ba2+ + 2e
a. Tác dụng với phi kim (oxi, halogen….)
2Ba + O2 → 2BaO
Ba + Cl2 →BaCl2
b. Tác dụng với axit
- Với dung dịch axit HCl:
Ba + 2HCl → BaCl2 + H2
- Với dung dịch HNO3:
Ba + 4HNO3 đặc → Ba(NO3)2 + 2NO2 + 2H2O.
+ Lưu ý: Kim loại Ba dễ dàng phản ứng với hầu hết axit, với ngoại lệ là axit sunfuric, phản ứng dừng lại khi tạo thành lớp muối không tan trên bề mặt là bari sulfat.
c. Tác dụng với nước
- Ở nhiệt độ thường, Ba khử nước mạnh:
Ba + 2H2O → Ba(OH)2 + H2
Điều chế
* Điện phân nóng chảy Bari clorua (BaCl2)
- Tiến hành thực hiện điều chế trong lò điện chứa chất Bari clorua nóng chảy.
- Khi có dòng điện qua Bari clorua => phân hủy tạo Bari kim loại và khí clo.
BaCl2 → Ba + Cl2
* Phản ứng giữa Bari oxit (BaO) và nhôm (Al) ở nhiệt độ cao
- Tiến hành thực hiện phản ứng Bari oxit (BaO) và nhôm (Al) (nhiệt độ từ 1100 đến 12000C)
- Bari oxit phản ứng với nhôm để tạo thành bột Bari nhôm oxit (BaO.Al2O3) và Bari kim loại.
4BaO + 2Al → BaO.Al2O3 + 3Ba
Ứng dụng
- Bari được ứng dụng chủ yếu trong sản xuất buji, ống chân không, pháo hoa và bóng đèn huỳnh quang.
- Màu trắng của hợp chất bari sulfat được sử dụng trong sản xuất sơn, thủy tinh và trong chẩn đoán bằng tia X.
- Hợp chất Bari cacbonat được ứng dụng làm bả chuột, sản xuất thủy tinh và gạch.
- Để tạo màu xanh lá cây trong sản xuất pháo hoa người ta dùng hợp chất Bari nitrat và bari clorua
- Hợp chất Bari sulfua không tinh khiết phát lân quang sau khi đặt dưới ánh sáng.
- Muối của Bari (bari sulfat) dùng trong y học truyền cho bệnh nhân làm tăng độ tương phản của những tấm phim X quang trong việc chẩn đoán hệ tiêu hóa.
Một số hợp chất
* Bari hidroxit: Ba(OH)2
- Là chất rắn, có màu trắng, tan tốt trong nước, dễ hút ẩm.
- Dung dịch Ba(OH)2 làm quỳ tím chuyển sang màu xanh hoặc làm dung dịch phenolphthalein chuyển sang màu hồng do có tính bazo
- Bari hiđroxit ngậm đơn nước (Monohydrat) được sử dụng để khử nước và loại bỏ sunfat từ các sản phẩm khác nhau
* Bari clorua: BaCl2
- Là chất rắn, có màu trắng và tan tốt trong nước.
- Có độc tính.
- Đốt cho ngọn lửa màu xanh lá cây sáng.
- Bari clorua chủ yếu được sử dụng trong việc tinh chế dung dịch nước muối trong các nhà máy clorua caustic và cũng trong sản xuất muối xử lý nhiệt, thép, trong sản xuất bột màu, và trong sản xuất các muối bari khác.
* Bari sunfat: BaSO4
- Bari sunphat tồn tại ở dạng tinh thể rắn, màu trắng, không mùi và không tan trong nước.
- BaSO4 được sử dụng làm chất phụ gia trong sản xuất sơn (sơn dầu, sơn gỗ, sơn tàu biển, sơn chịu nhiệt, sơn tĩnh điện, sơn nhà xưởng,...
- BaSO4 còn được sử dụng trong sản xuất mực in, có thể làm tăng độ bám dính, giữ cho màu sắc tươi sáng, rõ ràng, không phai.
* Bari cacbonat: BaCO3
- Là chất rắn có màu trắng, không tan trong nước.
- Có trong tự nhiên ở dạng khoáng vật witherit.
- Bari cacbonat được sử dụng rộng rãi trong ngành công nghiệp gốm sứ như một thành phần trong men sứ.
- Trong công nghiệp gạch, ngói, đất nung và gốm, bari cacbonat được thêm vào đất sét để kết tủa các muối hòa tan (canxi sunfat và magie sunfat) là những chất tạo ra hiện tượng nở hoa.
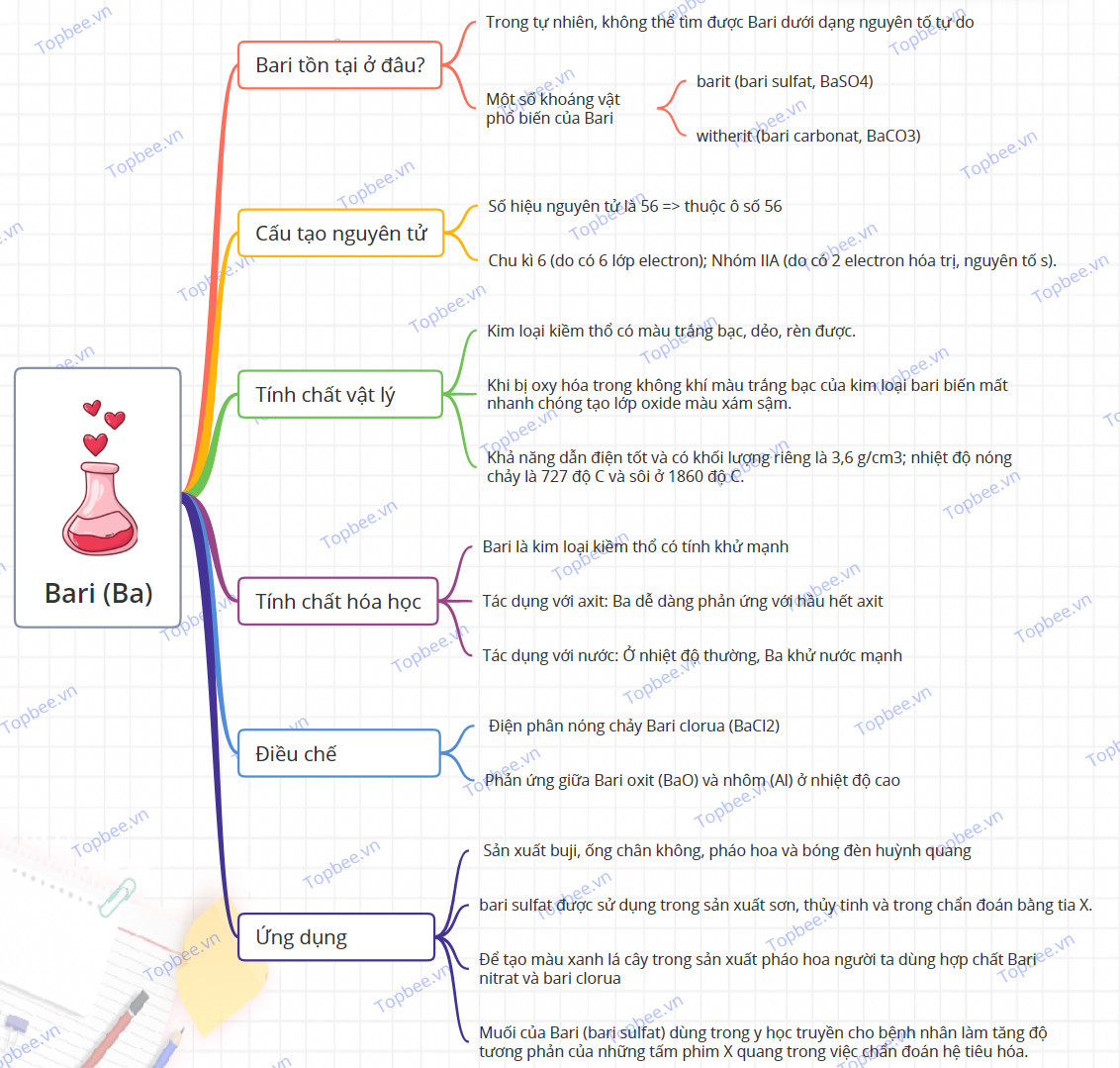
Sơ đồ tư duy
Một số câu hỏi
Câu 1: Cho nguyên tử khối của Bari là 137. Tính khối lượng thực nguyên tố trên.
Câu 2: Dẫn 4,48 lít CO2 (đktc) vào 200 ml dung dịch gồm NaOH 1M và Ba(OH)2 1M thu được m (g) kết tủa. Tính m
Câu 3: Hiện tượng xảy ra khi nhỏ từ từ đến dư dung dịch Ba(OH)2 vào dung dịch chứa H2SO4 là:
A. xuất hiện kết tủa trắng sau đó tan một phần.
B. có chất khí không màu bay lên.
C. xuất hiện kết tủa trắng,
D. xuất hiện kết tủa trắng sau đó tan hết, dung dịch trong suốt
Câu 4: Bari có cấu trúc tinh thể theo kiểu nào?
A. Lập phương tâm khối
B. Lục phương
C. Lập phương tâm diện
D. Lập phương
Câu 5: Hiện tượng xảy ra khi sục từ từ khí CO2 đến dư vào dung dịch Ba(OH)2 là:
A. Xuất hiện kết tủa trắng.
B. Ban đầu tạo kết tủa trắng, sau đó tan dần.
C. Sau 1 thời gian mới xuất hiện kết tủa trắng.
D. Không xuất hiện kết tủa.





