

Brom | Br (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 24/12/2023
24/12/2023
Bài viết tìm hiểu về Brom (Br) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Brom (Br): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
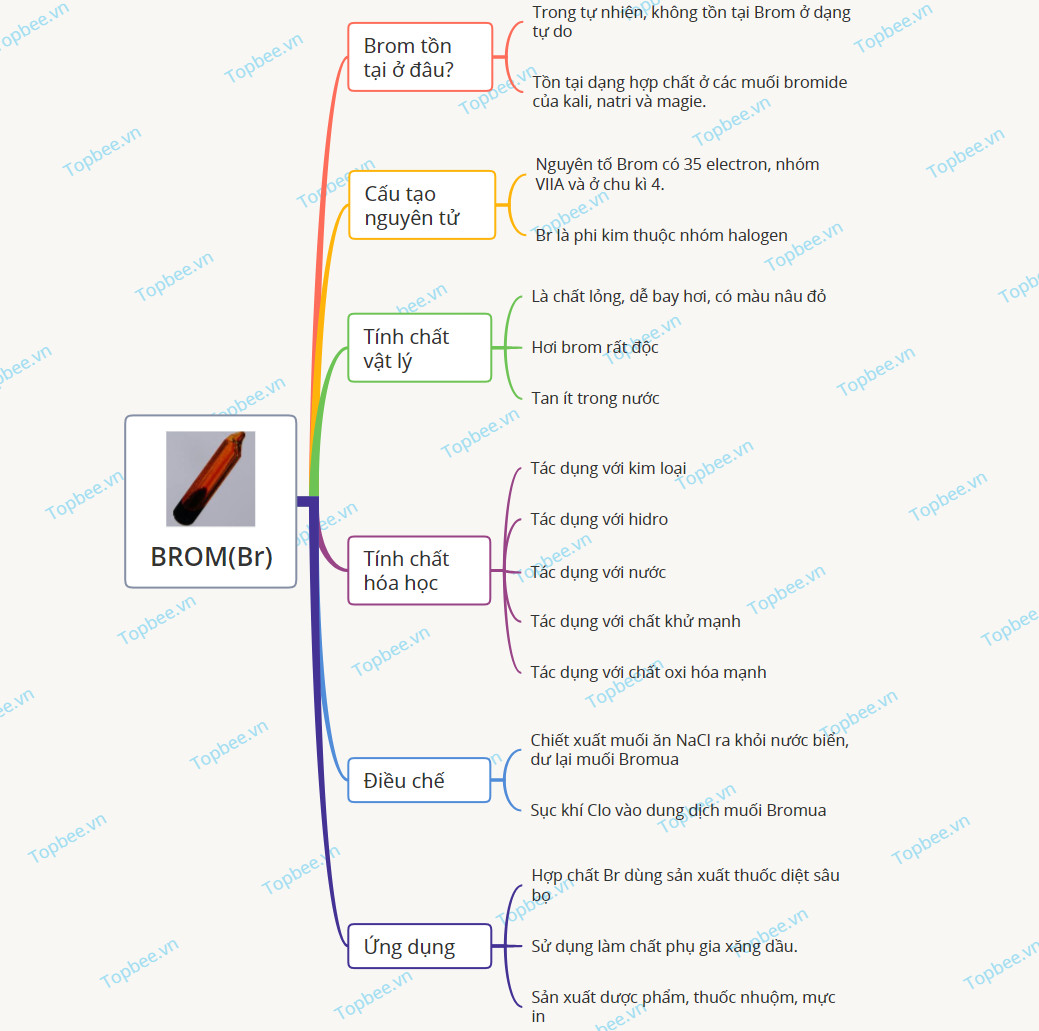
Brom tồn tại ở đâu?
+ Brom là nguyên tố hóa học có ký hiệu là Br và số hiệu nguyên tử là 35 trong bảng tuần hoàn hóa học.
+ Trong tự nhiên, không tồn tại Brom ở dạng tự do.
+ Brom tồn tại chủ yếu ở dạng hợp chất màu đỏ nâu ở các muối bromide của kali, natri và magie.
+ Ngoài ra, Brom có trong nước biển và nước hồ.
Cấu tạo nguyên tử
+ Cấu hình electron:1s22s22p63s23p64s24p5
Viết gọn [Ar]4s24p5
+ Nguyên tố Brom có 35 electron, nhóm VIIA và ở chu kì 4.
+ Br là nguyên tố hóa học thuộc nhóm Halogen.
+ Hai đồng vị bền của Brom là: 79Br và 81Br
Tính chất vật lý
+ Ở điều kiện bình thường, brom là chất lỏng, dễ bay hơi, có màu nâu đỏ
+ Brom tan ít trong nước, tan nhiều trong dung môi hữu cơ như benzen hay cacbon tetraclorua.
+ Brom và hơi brom rất độc, có thể gây bỏng nặng nếu dây vào da
Tính chất hóa học
Brom là chất oxi hoá mạnh, nhưng kém clo.
* Tác dụng với kim loại:
- Brom phản ứng trực tiếp với nhiều kim loại ở nhiệt độ thường, các phản ứng đều toả ra nhiều nhiệt.
3Br2 + 2Al → 2AlBr3
* Tác dụng với Hidro:
- Brom chỉ oxi hóa được H2 ở nhiệt đun nóng:
Br2 + H2 → 2HBr
* Lưu ý:
- Hiđro bromua tan trong nước tạo thành các axit tương ứng có cùng công thức : axit bromhiđric HBr. HBr là các axit mạnh và mạnh hơn
axit HCl.
- Dung dịch HBr không màu, để lâu trong không khí chuyển sang màu vàng nâu do bị oxi hóa:
4HBr + O2 → 2H2O + 2Br2
* Tác dụng với nước:
- Brom tác dụng rất chậm với nước tạo ra axit HBr và axit HBrO (axit hipobromơ):
Br2 + H2O → HBr + HBrO
- Đây là một phản ứng thuận nghịch.
* Halogen mạnh đẩy halogen yếu ra khỏi muối:
- Brom đẩy được Iot ra khỏi dung dịch NaI, nhưng clo lại đẩy được brom ra khỏi dung dịch NaBr:
Br2 + 2NaI → 2NaBr + I2
Cl2 + 2NaBr → 2NaCl + Br2
=> Clo hoạt động hoá học hơn Brom, Brom hoạt động hoá học hơn Iot.
* Tác dụng với chất khử mạnh:
- Brom khi tác dụng với chất khử mạnh thể hiện tính oxi hóa:
Br2 + SO2 + H2O → H2SO4 + 2HBr
* Tác dụng với chất oxi hóa mạnh:
- Brom khi tác dụng với chất ôxi hóa mạnh thể hiện tính khử:
Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
Điều chế
+ Nguyên liệu chính để điều chế Br là nước biển.
+ Sau khi chiết xuất muối ăn NaCl ra khỏi nước biển, phần dư lại đó chứa nhiều các muối Bromua của Natri và Kali.
+ Tiến hành sục khí Clo vào dung dịch muối Bromua sẽ thu được Brom nguyên chất.
Cl2 + NaBr → 2NaCl + Br2
Ứng dụng
Brom được ứng dụng trong rất nhiều lĩnh vực của cuộc sống:
- Các hợp chất brom hữu cơ dùng để sản xuất thuốc trừ sinh vật gây hại, thuốc diệt sâu bọ và các loài động vật gặm nhấm.

- Dùng làm chất chống cháy, trong đó chất chống cháy brom hoá phổ biến nhất chính là tetra bromo bisphenol - A (TBBPA ).
- Sử dụng làm chất phụ gia xăng dầu.
- Các hợp chất bromua dạng lỏng được dùng làm dung dịch khoan trong những giếng khoan sâu và có áp suất cao
- Brom mang lại hiệu quả tốt hơn các chất khử trùng khác khi khử trùng bể bơi.
- Brom còn được ứng dụng trong sản xuất dược phẩm, thuốc nhuộm, mực in và làm thuốc hiện hình trong nghề ảnh.
Một số hợp chất
* Khí hiđro bromua hay Axit bromhiđric: HBr
- Là chất lỏng không màu và tan trong nước, HBr là một axit mạnh
- Axit bromhidric được dùng để điều chế các muối bromua như: kẽm bromua, canxi bromua, natri bromua.
- HBr là chất xúc tác cho các phản ứng ankyl hóa, giúp tách chiết các quặng.
* Hợp chất chứa oxi của Brom:
- Axit hipobromo: HBrO
+ Là một axit yếu, không bền
+ Tồn tại chủ yếu dưới dạng dung dịch.
+ HBrO được sử dụng như một chất tẩy trắng, chất oxy hóa, chất khử mùi và chất khử trùng.
- Axit bromic: HBrO3
+ Là một axit có tính oxi hóa mạnh
+ Chỉ tồn tại ở dạng dung dịch .
+ Chuyển vàng ở nhiệt độ phòng do HBrO3 phân hủy thành brom
+ HBrO3 nó cực kỳ nguy hiểm trong trường hợp tiếp xúc với da, tiếp xúc với mắt, hay khi nuốt phải.
- Axit pebromic: HBrO4
+ Tồn tại dưới dạng chất lỏng, không màu, không mùi.
+ Là một axit mạnh và có tính oxi hóa mạnh.
+ HBrO4 là chất khử dùng trong các phản ứng hóa học của phòng thí nghiệm.
Sơ đồ tư duy về Brom
Một số câu hỏi về Brom và hợp chất của Brom
Câu 1: Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → H2SO4 + 2HBr.
Brom đóng vai trò là:
A. chất khử.
B. vừa là chất oxi hóa vừa là chất khử
C. chất oxi hóa.
D. không là chất oxi hóa không là chất khử.
Câu 2: Tại sao ta không điều chế brom trong phòng thí nghiệm?
Câu 3: Một ancol X tác dụng với HBr được dẫn xuất Y chứa 58,4% brom về khối lượng. Tìm CTPT của X biết X là ancol no, đơn chức,
mạch hở.
Câu 4: Benzen có làm mất màu dung dịch Brom không? Giải thích?
Câu 5: Trong tự nhiên Brom có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung bình là 79,92. Thành phần phần trăm về khối lượng của
81Br trong NaBr là bao nhiêu? Có MNa =23 (g/mol).





