

Chì | Pb (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Chì (Pb) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Chì (Pb): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
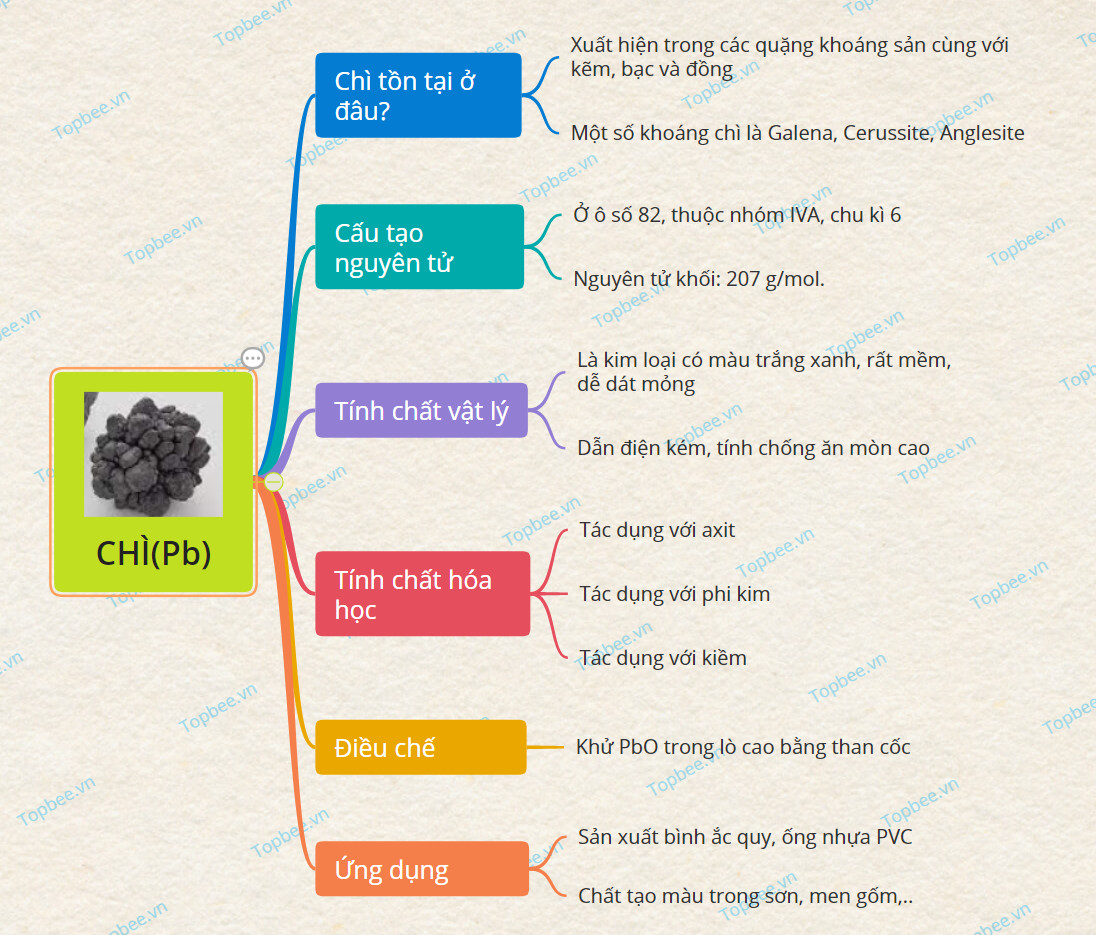
Chì tồn tại ở đâu?
+ Chì là nguyên tố hóa học có kí hiệu là Pb, số hiệu nguyên tử là 82 trong bảng tuần hoàn hóa học.
+ Nguyên tố này trong tự nhiên ít khi tồn tại dưới dạng kim loại đơn chất, mà thường xuất hiện trong các quặng khoáng sản cùng với kẽm,
bạc và đồng(phổ biến nhất).
+ Một số khoáng chì được phát hiện:
- Galena (PbS), với 86,6% khối lượng là chì.
- Cerussite (PbCO3).
- Anglesite (PbSO4).
Cấu tạo nguyên tử
+ Cấu hình electron của Chì là: [Xe] 4f145d106s26p2
+ Nguyên tử Pb có 82 electron, phân bố trên 6 lớp electron và số electron lớp ngoài cùng bằng 4.
+ Nguyên tố chì nằm ở ô số 82, thuộc nhóm IVA và có chu kì 6.
+ Khối lượng nguyên tử của Chì: 207 g/mol.
+ Chì có 3 đồng vị là: 202Pb, 204Pb, 207Pb.
Tính chất vật lý
+ Nguyên tố Chì là kim loại có màu trắng xanh, rất mềm, dễ dát mỏng.

+ Kim loại này dẫn điện kém hơn so với các kim loại trong cùng nhóm.
+ Tính chống ăn mòn của Pb rất cao
+ Chì có cấu trúc mạng tinh thể phân tử lập phương tâm mặt.
+ Nhiệt độ nóng chảy: 327,46 °C
+ Nhiệt độ sôi: 1749 °C.
Tính chất hóa học
Kim loại Chì có tính khử yếu.
Thế điện cực chuẩn của chì E0Pb2+/Pb = – 0,13V.
*Tác dụng với phi kim
Ví dụ:
Pb + F2 → PbF2
Pb + O2 → PbO
-Trong không khí, Pb bị oxi hóa tạo một lớp chì oxit mỏng ở bề mặt kim loại. Nhưng lớp ôxit bảo vệ bên ngoài này giúp chì không bị ôxi
hóa tiếp.
*Tác dụng với axit
- Do các muối chì không tan bao bọc bên ngoài kim loại nên Pb không tác dụng với các dung dịch HCl và H2SO4 loãng
- Khi tác dụng với dung dịch H2SO4 đặc nóng, Chì tan nhanh và tạo thành muối Pb (HSO4)2 và giải phóng khí SO2:
Pb + 3H2SO4 → Pb(HSO4)2 + SO2 ↑ + 2H2O.
- Chì dễ tan trong dung dịch HNO3:
3Pb + 8HNO3 (loãng, nóng) → 3Pb(NO3)2 + 2NO ↑ + 4H2O.
- Chì tan chậm trong HNO3 đặc.
*Tác dụng với dung dịch kiềm
– Trong dung dịch kiềm nóng, Chì tan rất chậm:
Pb + 2NaOH (đặc) + 2H2O → Na2[Pb(OH)4] + H2 ↑
Điều chế
+ Đốt cháy quặng chì sulfua sẽ giải phóng Chì oxit, hỗn hợp sulfat và silicat của chì và các kim loại khác.
- Sau đó khử Chì oxit trong lò cao bằng than cốc sẽ tạo ra Chì:
PbO + CO → Pb + CO2
Ứng dụng
+ Là nguyên liệu chính để sản xuất bình ắc quy các loại xe, ống nhựa ,…
+ Chì được ứng dụng như một chất nhuộm trắng trong sơn.
+ Tạo màu trong quá trình tráng men, điển hình nhất là màu đỏ, màu vàng.
+ Chì được sử dụng làm những tấm chắn chống đạn và phóng xạ hạt nhân.
+ Duy trì trọng lượng cho dây cáp trong việc khai thác dầu khí từ đáy biển.
+ Dùng việc gia công và hàn các linh kiện điện tử
Một số hợp chất
*Chì (II) oxit: PbO
- Là chất rắn, không tan trong nước.
- Chì oxit có 2 dạng thù hình:
+ Đỏ - cấu trúc tinh thể tứ giác.
+ Vàng - cấu trúc tinh thể thoi trực giao.
- PbO có tính chất hóa học của một oxit lưỡng tính
*Chì (II) hiđroxit: Pb(OH)2
- Là chất rắn, có màu trắng, không tan trong nước
- Pb(OH)2 là một hiđroxit của chì với số oxi hóa +2.
- Pb(OH)2 có tính chất hóa học của một hiđroxit lưỡng tính.
*Chì (II) sunfat: PbSO4
- Là chất rắn, có màu trắng, không tan trong nước.
- Chì sunfat còn có tên khác là sữa trắng, muối chì axit sunfuric hoặc anglesite.
- Pb(OH)2 có tính độc cao, gây độc hại khi hít phải, ăn mòn khi tiếp xúc với da.
*Muối chì (II): PbCl2
- Là chất rắn màu trắng, không mùi, không tan trong nước và ancol
- Trong tự nhiên, PbCl2 tồn tại dưới dạng khoáng cotunnit
- Chì (II) clorua là một trong những chất thử chì quan trọng nhất.
- Phản ứng thay thế cation của PbCl2 được ứng dụng trong tổng hợp chì titanat (PbTiO3) và gốm sứ bari chì titanat
Sơ đồ tư duy về Chì
Một số câu hỏi về Chì và hợp chất của Chì
Câu 1: Nguyên tố chì có 4 đồng vị : 204Pb (2,5%), 206Pb (23,7%),207Pb (22,4%),còn lại là 208Pb. Tính nguyên tử khối trung bình của chì.
Câu 2: Biết rằng ion Pb2+ trong dung dịch oxi hóa được Sn. Khi nhúng hai thanh kim loại Pb và Sn được nối với nhau bằng dây dẫn điện
vào một dung dịch chất điện li thì
A. Cả Pb và Sn đều bị ăn mòn điện hóa.
B. Cả Pb và Sn đều không bị ăn mòn điện hóa.
C. Chỉ có Pb bị ăn mòn điện hóa.
D. Chỉ có Sn bị ăn mòn điện hóa.





