

KI + AgNO3 → KNO3 + AgI ( ↓) | Cân bằng PTHH Potassium iodide
 27/6/2024
27/6/2024
Cân bằng PTHH: KI + AgNO3 → KNO3 + AgI ( ↓) chính xác và dễ hiểu nhất kèm theo bài tập vận dụng có đáp án chi tiết
1. Loại phản ứng
Phản ứng trao đổi
2. Cân bằng PTHH:
KI + AgNO3 → KNO3 + AgI ( ↓)
3. Điều kiện xảy ra phản ứng/ Xúc tác phản ứng
Điều kiện thường.
4. Cách tiến hành thí nghiệm
Nhỏ dung dịch KI vào ống nghiệm chứa AgNO3.
5. Chất tạo ra từ phản ứng:
- KNO3 tồn tại ở dạng bột màu trắng, không mùi, tan nhiều trong nước, có tính oxy hóa mạnh và dễ cháy nổ khi tiếp xúc với nhiệt độ cao.
- KI tồn tại ở dạng bột màu trắng trong trạng thái tinh khiết và hòa tan tốt trong nước.
6. Hiện tượng quan sát từ phản ứng
Có kết tủa vàng
7. Ứng dụng của PTHH trên
- Phương trình hóa học trên có vai trò là nguồn cung cấp Potassium và Nitrogen thiết yếu cho cây trồng, chế tạo thuốc súng, pháo hoa, chất bảo quản thực phẩm,... ngoài ra được dùng để điều trị cường giáp, bảo vệ tuyến giáp và làm giảm hấp thụ iod phóng xạ vào cơ thể.
8. Bài tập vận dụng
Bài tập 1: Nhỏ từ từ một vài giọt KI vào ống nghiệm có chứa 1ml AgNO3 thu được kết tủa có màu
A.trắng.B. đen.C. vàng.D. nâu đỏ.
Lời giải
KI + AgNO3 → KNO3 + AgI ( ↓)
AgI: kết tủa vàng.
Đáp án C.
Bài tập 2: Chất nào sau đây không thể phản ứng với AgNO3?
A.HF.B. KI.C. HI.D, KBr.
Lời giải
HF không phản ứng với AgNO3.
Đáp án A.
Bài tập 3: Khối lượng kết tủa thu được khi cho KI phản ứng vừa đủ với 100ml AgNO3 0,1M là
A.2,35g.B. 1,88g.C.1,44g.D. 2,00g
Lời giải
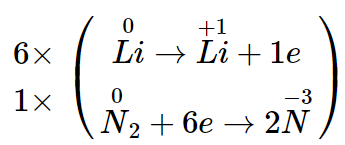
m ↓ = 0,01. =2,35g
Đáp án A.





