

Mangan | Mn (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Mangan (Mn) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Mangan (Mn): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
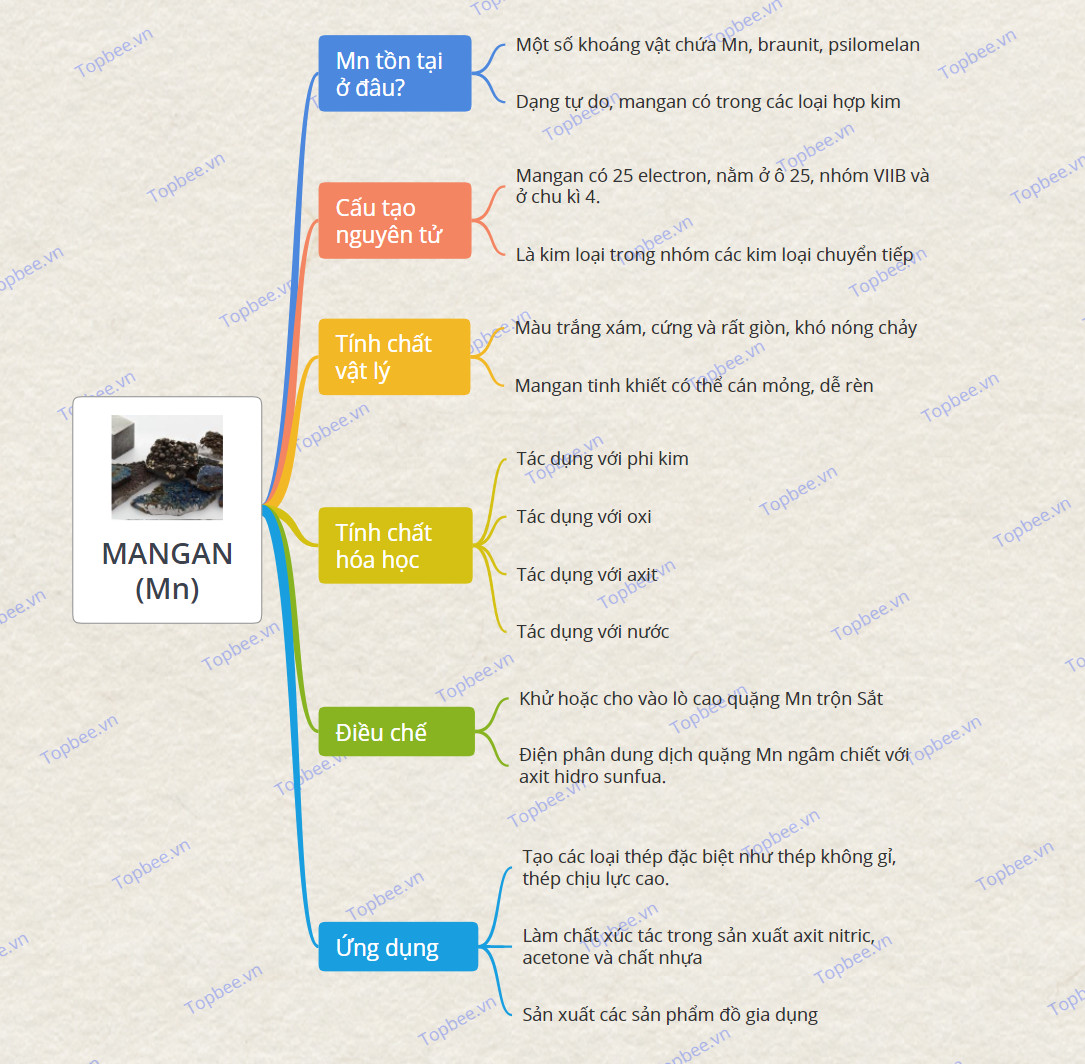
Mangan tồn tại ở đâu?
+ Mangan, là nguyên tố hóa học trong bảng tuần hoàn có ký hiệu Mn và số nguyên tử là 25 trong bảng tuần hoàn hóa học.
+ Mangan chiếm khoảng 0,1% khối lượng trong vỏ Trái Đất, đứng hàng thứ 12 về mức độ phổ biến của các nguyên tố
+ Trong tự nhiên, Mn ở dạng tự do trong tự nhiên, và trong một số loại khoáng vật.
- Một số khoáng vật chứa Mangan: pyrolusit (MnO2), braunit, (Mn2+Mn3+ 6)(SiO12), psilomelan (Ba,H2O)2Mn5O10, rhodochrosit
(MnCO3),..
- Dạng tự do, mangan có trong các hợp kim công nghiệp
Cấu tạo nguyên tử
-Cấu hình electron: 1s22s22p63s23p63d54s2 hay [Ar] 3d54s2.
-Nguyên tố Mangan có 25 electron, nằm ở ô 25, nhóm VIIB và ở chu kì 4.
- Mangan là một kim loại trong nhóm các kim loại chuyển tiếp
- Các đồng vị của Mn: 52Mn, 53Mn, 54Mn, 55Mn
- Mangan có thể có các hóa trị từ -3 đến +7.
Tính chất vật lý
+ Là kim loại có màu trắng xám, cứng và rất giòn, khó nóng chảy, nhưng lại bị ôxi hóa dễ dàng.
+ Có từ tính qua quá trình xử lý đặc biệt.
+ Mangan có một số dạng thù hình khác nhau về mạng lưới tinh thể và tỉ khối. Đặc biệt dạng α và mạng lưới lập phương tâm khối có độ
bền cao với điều kiện nhiệt độ thường.
+ Mangan là kim loại có nhiệt độ nóng chảy cao lên đến 12440C, khó sôi với nhiệt độ sôi lên đến 20800C.
+ Mangan tinh khiết có thể cán mỏng, dễ rèn. Nhưng khí nó chứa hợp chất thì Mangan trở nên cứng hơn, giòn và bị oxi hóa dễ dàng.
Tính chất hóa học
*Mangan tác dụng với phi kim
Mangan là kim loại có thể tác dụng trực tiếp với nhiều phi kim. Cụ thể như sau:
*Tác dụng với oxi:
+ Mn dễ bị oxi hóa trong không khí, tạo màng oxit Mn2O3 bảo vệ kim loại. Nên kim loại không bị oxi hóa ngay cả ở nhiệt độ cao.
Mn + O2 → Mn2O3
3Mn + 2O2 → Mn3O4 (điều kiện t0)
*Tác dụng với phi kim:
+ Ở nhiệt độ cao, Mn tác dụng dễ dàng với các phi kim:
2Mn + 3F2 → 2MnF3 (điều kiện t0)
Mn + Cl2 → MnCl2 (điều kiện t0)
+ Ngoài ra, còn tác dụng với các phi kim khác như: S, N2, Si, C, P,...
*Mangan tác dụng với axit:
+ Với axit loãng như: HCl hoặc H2SO4 sẽ tạo muối Mangan II và khí Hidro:
Mn (bột) + 2HCl (loãng) → MnCl2 + H2
+ Với axit H2SO4(đặc) và axit HNO3(loãng, nóng), Mangan sẽ khử được N+5 và S+6 xuống mức oxi hóa thấp hơn:
3Mn + 8HNO3 (loãng, nóng) → 3Mn(NO3)2 + 2NO + 4H2O.
Mn + 2H2SO4 (đặc) → MnSO4 + SO2 + 2H2O
*Tác dụng với nước:
+ Mangan tác dụng với nước tạo hợp chất Mangan hidroxit và giải phóng khí H2:
Mn (bột) + 2H2O (hơi) → Mn(OH)2 + H2
Điều chế
+ Cho quặng Mangan trộn với quặng Sắt và Cacbon.
+ Hỗn hợp này sẽ được khử hoặc cho vào lò cao hoặc lò điện hồ quang.
+ Cho quặng Mangan đã được ngâm chiết với axit H2SO4 sau đó điện phân dung dịch sẽ thu được Mangan tinh khiết.
Ứng dụng
- Mangan nguyên liệu để tạo ra các loại thép đặc biệt như thép không gỉ và thép chịu lực cao.
- Làm chất xúc tác trong sản xuất axit nitric, acetone và chất nhựa.
- Mn được ứng dụng trong các loại pin alkaline và ắc quy
- Sản xuất các sản phẩm đồ gia dụng như nồi, chảo và các vật dụng khác.
- Hợp chất Kali pemanganat KMnO4 dùng làm chất tẩy uế trong hóa học và y khoa.
- Mangan được sử dụng trong y học để điều trị bệnh parkinson và các bệnh về xương khớp.
Một số hợp chất
- Mangan (II) clorua: MnCl2
+ Hợp chất muối này có màu hồng nhạt
+ MnCl2 được sử dụng trong sản xuất pin khô, tẩy uế; lọc sạch khí tự nhiên; máy sấy dầu lanh,..
- Mangan (II) cacbonat: MnCO3
+ Là một hợp chất vô cơ màu hồng nhạt, không tan trong nước
+ MnCO3 tồn tại trong tự nhiên dưới dạng khoáng vật rhodochrosit
+ Mangan(II) cacbonat là chất phụ gia cho phân bón thực vật
+ Làm chất màu men trong gốm sứ, được sử dụng trong thực phẩm y tế
- Mangan (II) sunfat: MnSO4.
+ Là chất rắn dễ chảy nước màu hồng nhạt
+ Làm phụ gia trong ngành phân bón, thêm vào đất để thúc đẩy tăng trưởng thực vật
+ Đóng vai trò chất khử trong sản xuất sơn, véc ni sấy.
+ Ngoài ra, MnSO4 còn được ứng dụng trong thuốc nhuộm dệt may, thuốc diệt nấm, thuốc men và gốm sứ.
Sơ đồ tư duy về Mangan
Một số câu hỏi về Mangan và hợp chất của Mangan
Câu 1: Trong phản ứng hóa học sau:
3K2MnO4+ 2H2O → 2KMnO4 + MnO2 + 4KOH
Nguyên tố mangan đóng vai trò gì?
A. Chỉ bị oxi hóa.
B. Chỉ bị khử.
C. Vừa bị oxi hóa, vừa bị khử.
D. Không bị oxi hóa, không bị khử.
Câu 2: Mangan có những mức oxi hóa nào trong các hợp chất bền của mình:
1) +2 2) +5 3) +6 4) +7
A. 1
B. 1 , 3, 4
C. 1, 4
D. 1 , 2 , 3, 4
Câu 3: Nung 47,4 gam KMnO4 sau một thời gian thấy còn lại 44,04 gam chất rắn. Phần trăm theo khối lượng KMnO4 đã bị nhiệt phân là:
A. 50%
B. 70%
C. 80%
D. 65%
Câu 4: Những hợp chất nào của mangan không bền trong không khí?
1) Mn(OH)2
2) MnCl2
3) MnS.nH2O
4) MnO2
A. 1, 3
B. 1, 2
C. 1, 4
D. 1, 2, 3
Câu 5: Để điều chế được 165kg Mn từ Mn3O4 bằng phản ứng nhiệt nhôm cần 81kg nhôm. Hiệu suất của phản ứng là:
A. 88,89%
B. 70%
C. 67,79%
D. 75,25%





