

Alkane là gì? Công thức cấu tạo, đồng phân, tính chất, điều chế, bài tập vận dụng
 26/4/2024
26/4/2024
Alkane là một phần kiến thức quan trọng trong chương trình Hóa học 11. Bài viết dưới đây sẽ giúp cung cấp cho các em đầy đủ kiến thức về Alkane.
1. Alkane là gì?
Alkane là tên gọi mới của Ankan theo chương trình sách mới. Alkane là các hydrocarbon no mạch hở chỉ chứa liên kết đơn C-H và C-C trong phân tử. Chỉ có liên kết đơn C-C và C-H (bền vững và kém phân cực) nên alkane khá trơ về mặt hóa học.
2. Công thức cấu tạo, cách gọi tên và đồng đẳng của Alkane
2.1 Công thức tổng quát
CTPT chung: CnH2n+2 (n ≥ 1)
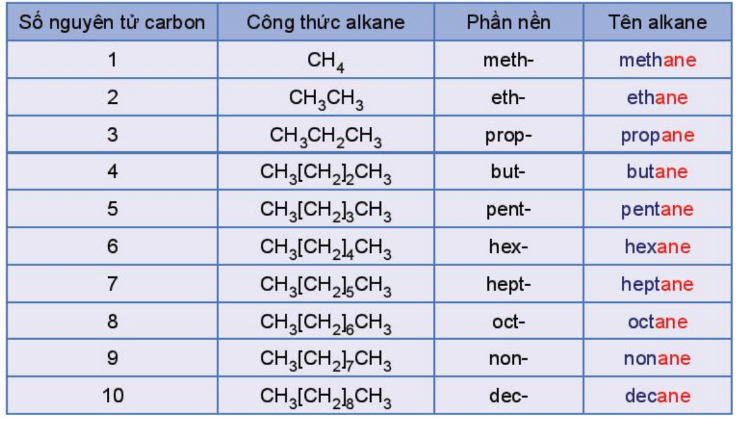
2.2 Cách gọi tên của các Alkane
a, Alkane không phân nhánh
Danh pháp thay thế = Phần nền + ane.
VD: CH4: mathane
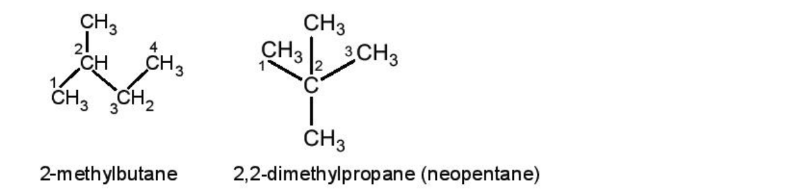
b, Alkane mạch nhánh
Tên gốc alkyl = Phần nền + yl
Tên danh pháp thay thế của alkane = Số chỉ vị trí mạch nhánh + tên alkane mạch chính
- Lưu ý:
+ Chọn mạch C dài nhất, có nhiều nhánh nhất làm mạch chính.
+ Đánh số sao cho mạch nhánh có số chỉ vị trí nhỏ nhất.
2.3 Đồng đẳng
Tên gọi chung là của các hidrocabon no mạch hở là alkene hoặc paraffin.
Công thức đơn giản nhất của ankan là mathane (CH4).
Mạch cacbon ở dạng mạch hở, có thể phân nhánh hoặc không phân nhánh.
Trong phân tử chỉ có liên kết đơn tạo thành từ 4 obitan lai hóa sp3 của nguyên tử cacbon, định hướng kiểu tứ diện đều. Vậy nên mạch cacbon có dạng gấp khúc. Các nguyên tử cacbon có thể xoay tương đối tự do xung quanh các liên kết đơn.
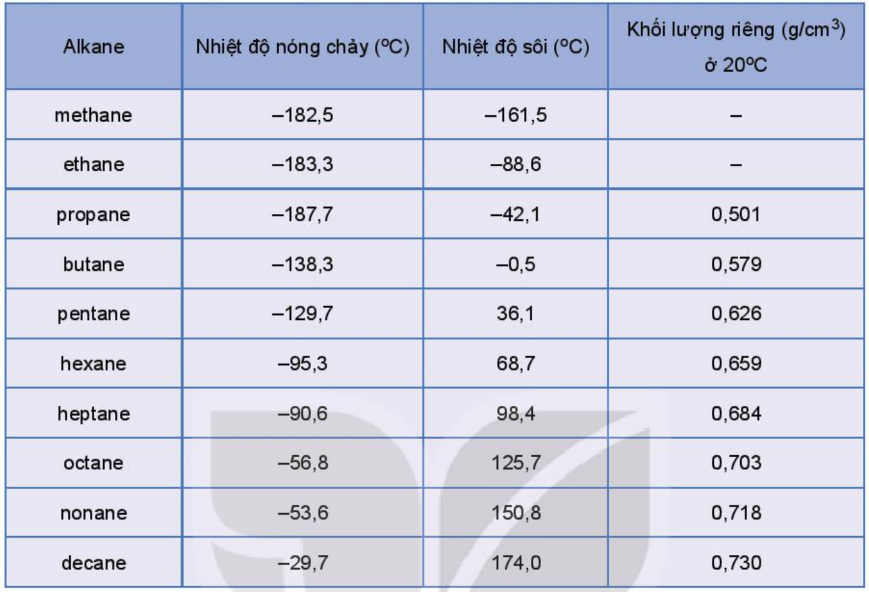
3. Tính chất vật lý của Alkane
- Trạng thái: C1 đến C4 và neopentan: khí, C5-C17: lỏng; C18 trở lên: rắn.
- Không tan trong nước, tan tốt hơn trong các dung môi hữu cơ.
- Nhẹ hơn nước.
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng theo chiều tăng phân tử khối.
4. Tính chất hoá học của Alkane
4. 1. Phản ứng thế
- Alkane phản ứng thế nguyên tử hydrogen trong alkane bằng nguyên tử halogen.
CnH2n+2 + X2 → CnH2n+2-mXm + HX
Phản ứng thế clo và brom: Xảy ra dưới xúc tác của askt hoặc nhiệt độ và tạo thành một hỗn hợp các sản phẩm.
Phản ứng thế Hidro bằng halogen thuộc phản ứng halogen hóa. Sản phẩm hữu cơ có chứa halogen gọi là dẫn xuất của halogen.
Clo thế được vào H ở các cacbon bậc khác nhau; Brom thì hầu như chỉ thế vào H ở cacbon bậc cao. Flo xảy ra phản ứng mãnh liệt nên phân hủy ankan thành C và HF. lot quá yếu nên không phản ứng được với alkene.
VD:
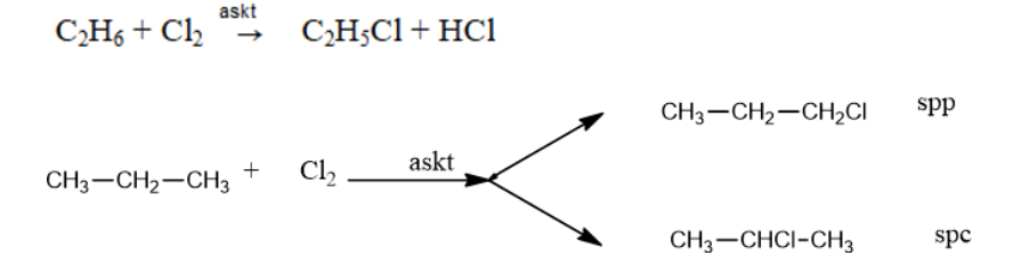
Những alkene có phân tử lớn tham gia phản ứng thế nhẹ hơn và ưu tiên tạo ra sản phẩm chính bằng cách thế vào những nguyên tử H của nguyên tử C bậc cao.
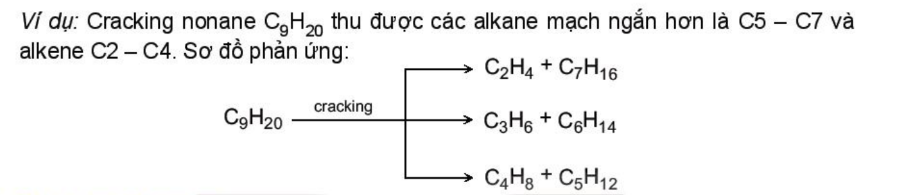
4. 2. Phản ứng cracking
- Cracking alkane là quá trình phân cắt liên kết C-C của các alkane mạch dài tạo thành hỗn hợp hydrocarbon có mạch carbon ngắn hơn.
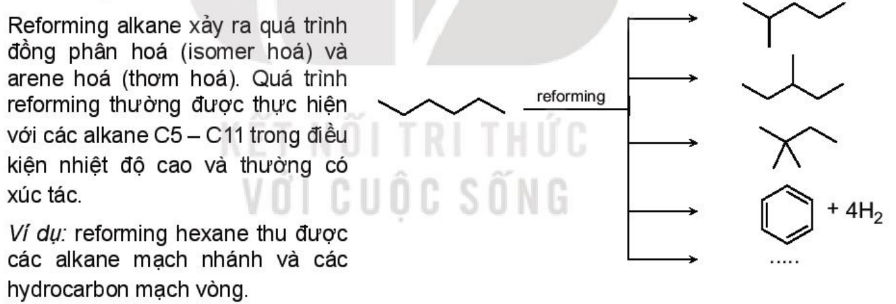
4. 3. Phản ứng reforming
- Reforming alkane là quá trình chuyển các alkane không phân nhánh thành các alkane mạch phân nhánh và mạch vòng nhưng không làm thay đổi số nguyên tử carbon trong phân tử.
4. 4. Phản ứng oxi hóa
a, Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1) H2O
Có:
+ nH2O < nCO2.
+ nH2O – nCO2 = nCnH2n+2.
b, Phản ứng oxi hóa không hoàn toàn
- Alkane bị oxi hóa thành hỗn hợp carboxylic acid.
RCH2-CH2R’ + O2 → RCOOH + R’COOH + H2O
5. Đồng phân Alkane
5.1. Đồng phân mạch cacbon
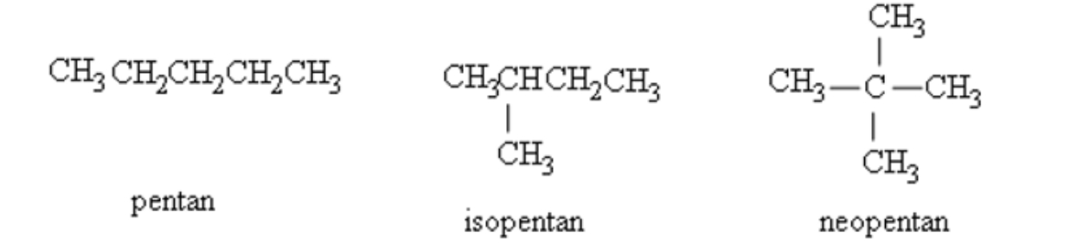
Alkane chỉ xuất hiện đồng phân khi mạch có từ 4C trở lên.
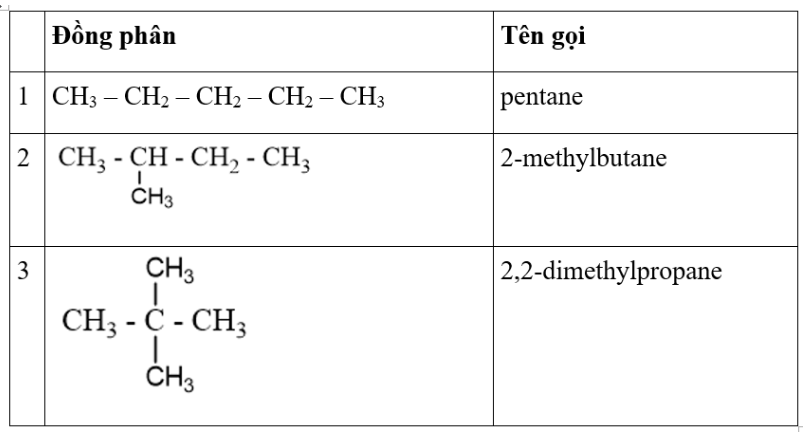
Ví dụ: Đồng phân của C5H12.
5.2. Bậc của cacbon trong Alkane
Bậc của Alkane chính là bậc của một nguyên tử cacbon trong phân tử Alkane bằng số nguyên tử cacbon liên kết trực tiếp với nó.
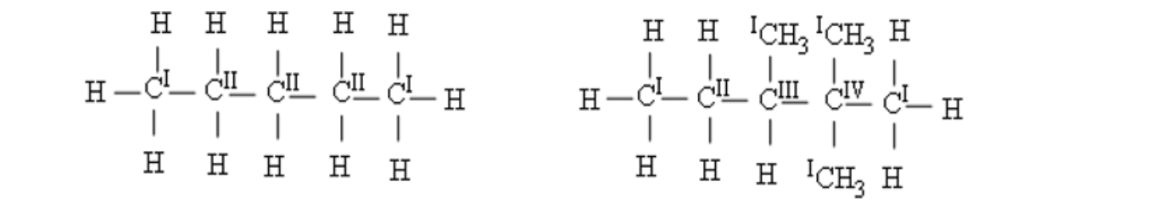
Alkane không phân nhánh là alkane chỉ chứa nguyên tử C bậc I hoặc bậc II trong mạch.
Alkane phân nhánh là alkane có chứa cả C bậc III hoặc C bậc IV.
6. Điều chế Alkane
6.1. Trong phòng thí nghiệm
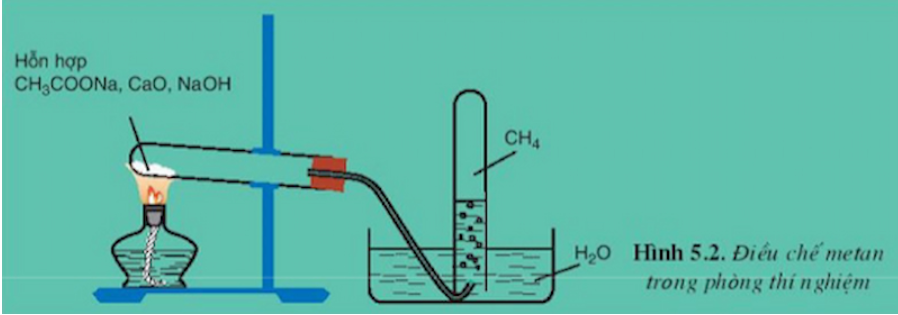
Trong phòng thí nghiệm, mathane được điều chế bằng cách đun nóng natri axetat khan với hỗn hợp vôi tôi xút theo phương trình:
CH3COONa + NaOH → CH4↑ + Na2CO3 (ĐK: CaO, nhiệt độ)
6.2. Trong công nghiệp
Điều chế Alkane ở thể khí trong công nghiệp
Các alkane ở thể khí chủ yếu được lấy từ khí thiên nhiên và khí dầu mỏ. Sau khi loại bỏ các hợp chất không phải là hydrocarbon (đặc biệt là H2S và CO2), khí được dẫn qua đường ống dẫn đến nơi tiêu thụ hoặc được nén lại ở dạng lỏng (hoá lỏng ở áp suất cao) để dễ dàng vận chuyển. Khí dầu mỏ hoá lỏng là LPG, còn khí thiên nhiên hoá lỏng là LNG (liquefied natural gas).
Điều chế Alkane ở thể rắn trong công nghiệp
Khi chưng cất dầu mỏ nhận được hỗn hợp alkane có chiều dài mạch carbon khác nhau ở các phân đoạn sôi khác nhau. Đề nhận được các alkane tinh khiết cần phải có các công nghệ tách và tinh chế rất phức tạp. Khí ngưng tụ chứa chủ yếu alkane C5 – C8, là sản phẩm thu được khi khai thác dầu - mỏ. Chúng được bơm lên cùng với dầu và được ngưng tụ thành chất lỏng. Khí ngưng tụ thường được chế biến thành xăng.
7. Ứng dụng của Alkane
- Nhiên liệu trong sản xuất và đời sống.
- Nguyên liệu sản xuât phân bón.
- Nhiên liệu xăng, diesel…
8. Một số bài tập trắc nghiệm về Alkane (có đáp án)
Câu 1: Viết các công thức cấu tạo và gọi tên theo danh pháp thay thế của alkane có công thức phân tử C5H12 và phân loại các đồng phân của nó.
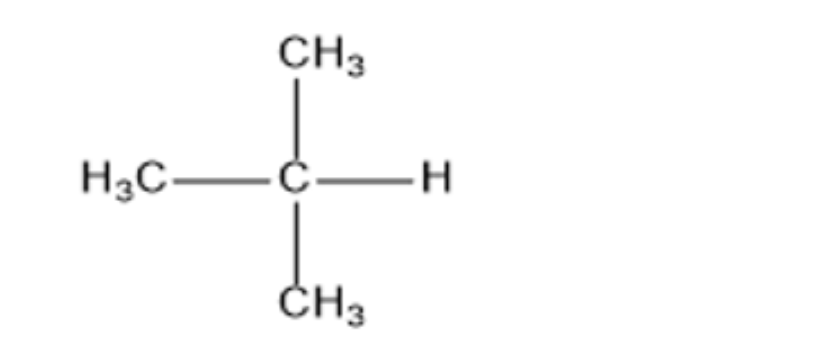
Câu 2: Viết công thức cấu tạo của alkane có tên gọi 2-methylpropane
Câu 3: Viết sơ đồ phản ứng của butane với bromine trong điều kiện có chiếu sáng, tạo thành các sản phẩm monobromine.
C4H10 + Br2 → C4H9Br + HBr
Câu 4: Viết phương trình hoá học của phản ứng đốt cháy hoàn toàn pentane.
C5H12 + 8O2 → 6H2O + 5CO2
Câu 5: Tại sao ở các cây xăng, kho chứa xăng dầu thường treo các biển cấm dưới đây?
Các alkane lỏng được sử dụng làm nguyên liệu xăng, dầu. Các alkane có phản ứng oxi hóa khi tiếp xúc với tia lửa: alkane bị đốt chát tạo khí carbon dioxide, hơi nước và giải phóng năng lượng gây cháy nổ mạnh.





