Axit cacboxylic (Là gì, TCHH, Ứng dụng, Mạnh hay yếu, Mindmap)
 8/1/2024
8/1/2024
Tổng hợp kiến thức về axit cacboxylic: Cấu tạo phân tử, Tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp họcsinh ôn tập, bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
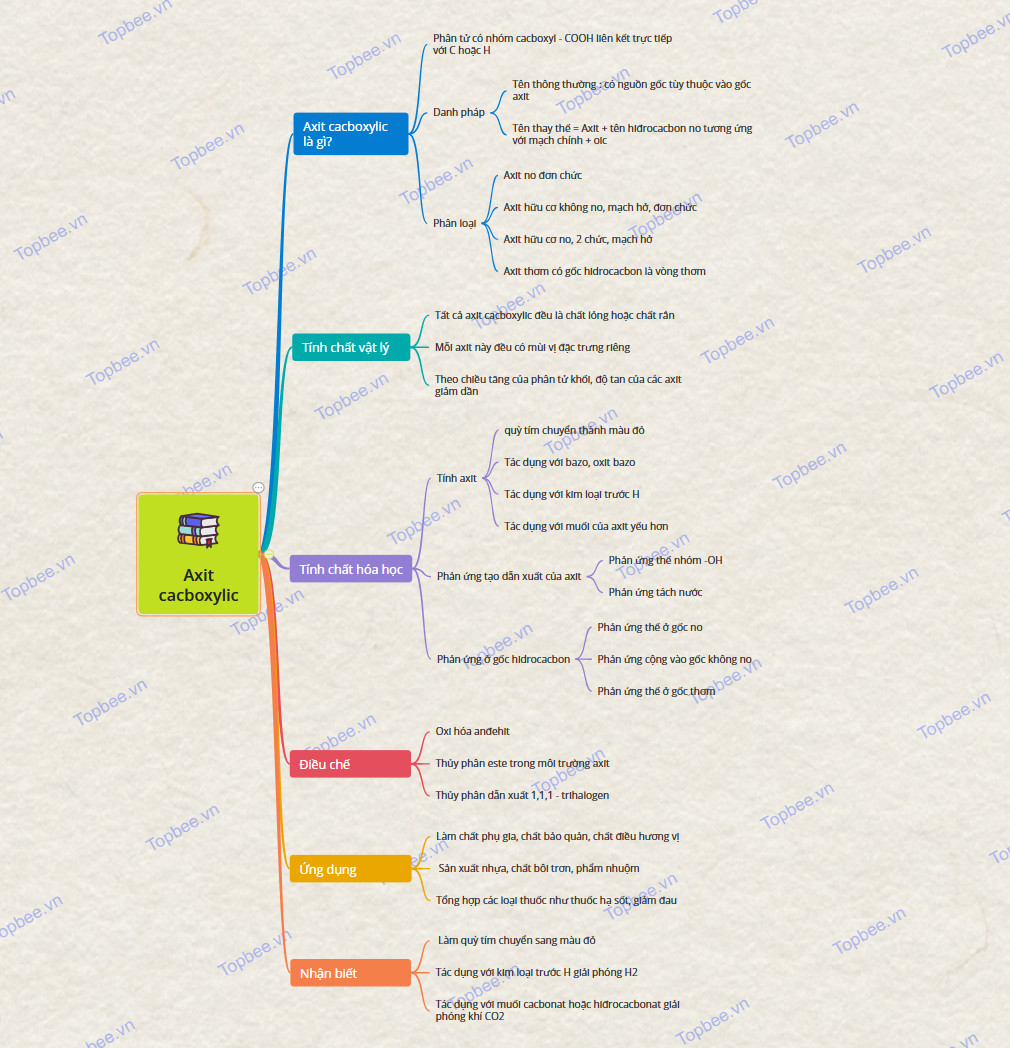
Axit cacboxylic là gì?
Định nghĩa
- Là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl - COOH liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
Cấu tạo
- Nhóm -COOH kết hợp bởi nhóm C = O và nhóm - OH.
- Liên kết O - H trong phân tử axit phân cực hơn liên kết O - H trong phân tử ancol, do đó nguyên tử H của nhóm COOH linh động hơn
nguyên tử H của nhóm – OH ancol.
- Liên kết C - OH của nhóm cacboxyl phân cực mạnh hơn liên kết C - OH của ancol, phenol nên nhóm - OH của axit cacboxylic cũng dễ
bị thay thế.
Danh pháp
- Tên thông thường : có nguồn gốc tùy thuộc vào gốc axit
- Tên thay thế của các axit no, đơn chức, mạch hở được xác định như sau:
+ Mạch chính của phân tử axit là mạch dài nhất, bắt đầu từ nhóm - COOH.
+ Mạch cacbon được đánh số bắt đầu từ nguyên tử cacbon của nhóm - COOH.
+ Tên thay thế = Axit + tên hiđrocacbon no tương ứng với mạch chính + oic.
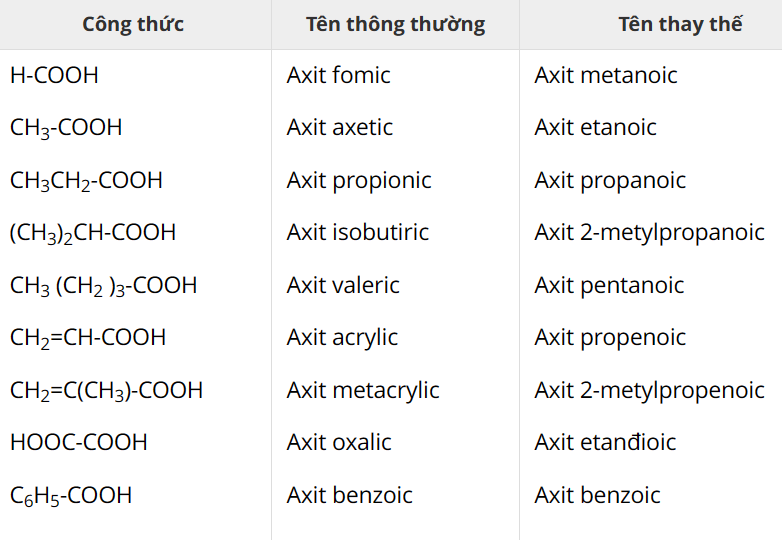
*Một số tên thông dụng của axit cacboxylic
Phân loại
+ Axit no đơn chức: CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1) gọi là dãy đồng đẳng của axit fomic (HCOOH). Ví dụ: CH3COOH (axit
axetic), CH3CH2COOH (axit propionic), ...
+ Axit hữu cơ không no, mạch hở, đơn chức trong gốc hiđrocacbon có 1 liên kết đôi: CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3)
Ví dụ CH2 = CH-COOH
+ Axit hữu cơ no, 2 chức, mạch hở: CnH2n(COOH)2 (n ≥ 0)
Ví dụ: HOOC-COOH (axit oxalic), HOOCCH2COOH (axit malonic), ...
+ Nếu gốc hiđrocacbon là vòng thơm thì gọi là axit thơm, ví dụ C6H5-COOH (axit benzoic), ...
Tính chất vật lý
- Tất cả axit cacboxylic đều là chất lỏng hoặc chất rắn ở điều kiện thường
- Mỗi axit này đều có mùi vị đặc trưng riêng.
- Từ C1 đến C3 tan vô hạn trong nước do tạo liên kết H liên phân tử với nước; C4 và C5 ít tan trong nước; từ C6 trở lên
không tan do gốc R có tính kị nước
- Theo chiều tăng của phân tử khối, độ tan của các axit giảm dần
- Nhiệt độ sôi cao hơn ancol, anđehit, xeton có cùng số nguyên tử cacbon.
Tính chất hóa học
*Tính axit
+ Axit làm quỳ tím chuyển thành màu .
+ Tác dụng với bazơ tạo ra muối và nước
R(COOH)x + xNaOH→R(COONa)x + xH2O
+ Tác dụng với oxit bazơ tạo ra muối và nước
2R(COOH)x + xNa2O→2R(COONa)x + xH2O
+ Tác dụng với kim loại đứng trước H tạo ra muối và giải phóng H2
2R(COOH)x + xMg→[2R(COO)x]Mgx + xH2
+ Tác dụng với muối của axit yếu hơn (muối cacbonat, phenolat, ancolat) → muối mới + axit mới
R(COOH)x + xNaHCO3→R(COONa)x + xH2O + xCO2
*Phản ứng tạo dẫn xuất của axit
- Phản ứng thế nhóm -OH:
+ Phản ứng giữa axit và ancol gọi là phản ứng este hóa.
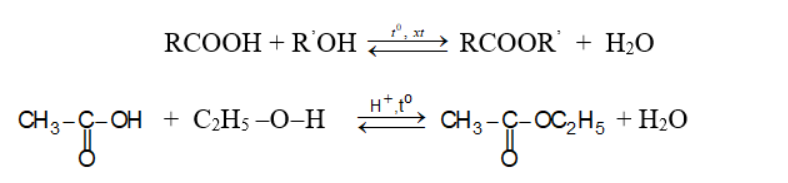
+ Chiều thuận là phản ứng este hoá, chiều nghịch là phản ứng thuỷ phân este
- Phản ứng tách nước: Hai phân tử axit tách đi một phân tử nước tạo thành phân tử anhiđrit axit với xúc tác P2O5
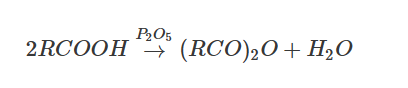
*Phản ứng ở gốc hidrocacbon
- Phản ứng thế ở gốc no: Cl chỉ thế cho H ở cacbon bên cạnh nhóm cacboxyl với xúc tác là photpho (P)
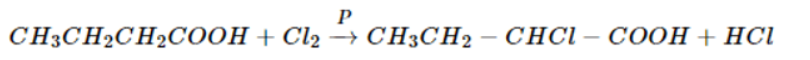
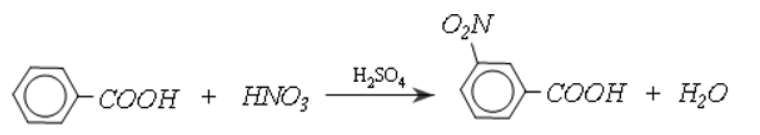
- Phản ứng thế ở gốc thơm: Nhóm cacboxyl ở vòng benzen định hướng cho phản ứng thế tiếp theo vào vị trí meta và làm cho phản ứng
khó khăn hơn so với thế vào benzen:
- Phản ứng cộng vào gốc không no: Axit không no tham gia phản ứng cộng với H2, Br2, Cl2, …
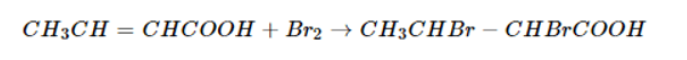
Axit cacboxylic là axit mạnh hay yếu
Axit cacboxylic là hợp chất hữu cơ có tính axit yếu do phân tử có chứa nhóm chức -COOH
Cách nhận biết axit cacboxylic
+ Làm quỳ tím chuyển sang màu đỏ
+ Tác dụng với kim loại trước H giải phóng H2
+ Tác dụng với dung dịch AgNO3/NH3 tạo kết tủa trắng Ag2CO3
+ Axit cacboxylic không no làm mất màu dung dịch thuốc tím hoặc nước brom
+ Tác dụng với muối cacbonat hoặc hiđrocacbonat giải phóng khí CO2.
Điều chế
- Oxi hóa anđehit (xúc tác Mn2+, t0)
CH3-CHO + 1/2O2 → CH3-COOH
R(CHO)x + x/2O2 → R(COOH)x
- Thủy phân este trong môi trường axit
CH3COOC2H5 + H2O → CH3-COOH + C2H5-OH
Ry(COO)xyR’x + xyH2O → yR(COOH)x + xR’(OH)y
- Thủy phân dẫn xuất 1,1,1 - trihalogen
RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O
- Một số phản ứng khác:
C6H5-CH3 → C6H5COOK → C6H5COOH
R-X → R-CN → R-COOH
CH3OH + CO → CH3COOH
Ứng dụng
+ Sản xuất nhựa, chất bôi trơn, phẩm nhuộm, nông dược,…
+ Axit formic làm chất khử trùng, chất xử lý vải dệt và làm chất khử axit.
+ Axit salixylic chế thuốc cảm, thuốc xoa bóp, giảm đau và làm đẹp da.
+ Axit stearic dùng sản xuất xà phòng, nến và mỹ phẩm.
+ Làm chất phụ gia, chất bảo quản, chất điều hương vị, chất tạo màu,…
+ Axit sorbic và axit benzoic có tác dụng ngăn chặn sự phát triển của vi khuẩn và nấm mốc trong thực phẩm.
+ Axit xitric là chất làm chua và chất bảo quản trong đồ uống, mứt.
+ Tổng hợp các loại thuốc như thuốc hạ sốt, giảm đau, kháng sinh, kháng viêm và kháng kị ứng.
+ Axit acetylsalicylic (aspirin) có tác dụng hạ sốt, giảm đau và làm loãng máu.
+ Axit butyric hoặc butanoic dùng trong quá trình tổng hợp hương liệu và một số loại thuốc.
Sơ đồ tư duy về Axit cacboxylic