Axit sunfuric | H2SO4 (Là gì, TCHH, Ứng dụng, Mạnh hay yếu, Mindmap)
 5/1/2024
5/1/2024
Tổng hợp kiến thức về axit sunfuric (H2SO4): Cấu tạo phân tử, tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp
học sinh ôn tập, bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
Axit sunfuric là gì?
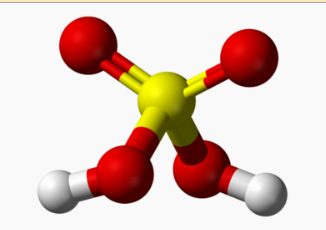
- Khái niệm: Axit sunfuric(hay vitriol) là một loại axit vô cơ gồm các nguyên tố lưu huỳnh, oxi và hidro.
- Cấu tạo phân tử: H2SO4.
- Axit sunfuric là axit không mùi.
Tính chất vật lý
- Là chất lỏng không màu, sánh, nặng hơn nước, tan vô hạn trong nước và rất khó bay hơi.
- Phân tử khối: 98 g/mol
- Nhiệt độ nóng chảy: 10°C, 283K
- Nhiệt độ sôi: 338°C (dung dịch 98%)
- H2SO4 có phản ứng tỏa nhiệt cao nên khi tiếp xúc, có thể gây bỏng hóa chất nghiêm trọng và thậm chí bỏng nhiệt thứ cấp
- Axit sunfuric có thể than hóa các hợp chất hữu cơ.
Tính chất hóa học
*Axit sunfuric loãng
- H2SO4 loãng làm đổi màu quỳ tím thành màu đỏ.
- Tác dụng với các kim loại đứng trước Hidro (trừ Pb) tạo thành muối sunfat:
Fe + H2SO4 (l) → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước:
FeO + H2SO4 (l) → FeSO4 + H2O
- H2SO4 loãng tác dụng với bazo tạo thành muối mới và nước:
H2SO4(l) + NaOH → NaHSO4 + H2O
H2SO4(l) + 2NaOH → Na2SO4 + 2H2O
- Tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới:
Na2CO3 + H2SO4 (l) → Na2SO4 + H2O + CO2
H2SO4 (l) + 2KHCO3 → K2SO4 + 2H2O + 2CO2
*Axit sunfuric đặc
- Tác dụng với kim loại:
+ Khi cho mảnh Đồng vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc:
Cu + 2H2SO4 (đ) → CuSO4 + SO2 + 2H2O
+ Tác dụng với phi kim tạo thành oxit phi kim, nước và giải phóng khí SO2
C + 2H2SO4 (đ) → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 (đ) → 2H3PO4 + 5SO2 + 2H2O
+ Tác dụng với các chất khử khác:
2FeO + 4H2SO4 (đ) → Fe2(SO4)3 + SO2 + 4H2O
+ H2SO4 đặc có tính háo nước: cho H2SO4 vào cốc đựng đường, phản ứng xảy ra làm đường chuyển sang màu đen và phun trào:
C12H22O11 + H2SO4 (đ) → 12C + H2SO4.11H2O
Axit sunfuric là axit mạnh hay yếu?
Axit H2SO4 là hợp chất vô cơ, tính điện ly mạnh phân ly hoàn toàn thành các ion của chúng trong nước nên nó có tính axit mạnh, tính oxi
hóa mạnh
Cách nhận biết axit sunfuric
+ Quỳ tím: Quỳ tím chuyển màu đỏ.
+ Dùng muối bari tan (như BaCl2, Ba(NO3)2) hoặc Ba(OH)2: Xuất hiện kết tủa trắng.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
+ Dùng kim loại như Zn hoặc Fe ,.. Kim loại tan dần và giải phóng khí
Fe + H2SO4 → FeSO4 + H2↑
+ Dùng muối cacbonat (như Na2CO3): phản ứng xảy ra có hiện tượng sủi bọt khí
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Phương pháp điều chế
+ Phòng thí nghiệm: Axit sunfuric H2SO4 không được điều chế trong phòng thí nghiệm
+ Trong công nghiệp H2SO4 được điều chế qua ba giai đoạn:
Giai đoạn 1: Đốt cháy lưu huỳnh (Hoặc quặng pirit sắt) ở nhiệt độ 1000 độ C để tạo ra khí SO2
S + O2 → SO2
Hay:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
Giai đoạn 2: Oxi hóa SO2 thành SO3 với xúc tác V2O5 ở nhiệt độ từ 450 - 500 độ C
2SO2 + O2 → 2SO3
Giai đoạn 3:
+ Khí SO3 được hấp thụ bằng dung dịch H2SO4 (nồng độ 98%):
SO3 + H2O → H2SO4
+ Một phần SO3 khác hòa tan trong H2SO4 tạo thành Oleum
H2SO4 + nSO3 → H2SO4.nSO3 (oleum)
+ Sử dụng nước thích hợp pha loãng Oleum
H2SO4.nSO3 + H2O → (n+1) H2SO4
Ứng dụng
+ Axit sunfuric sử dụng trong làm sạch kim loại, tẩy gỉ, loại bỏ các tạp chất
+ Sản xuất hóa chất như axit nitric, axit clohidric, nhôm sunfat,..
+ Tổng hợp thuốc nhuộm, thuốc, chất tẩy rửa, chất nổ, bình ác
+ Ứng dụng để sản xuất axit photphoric tạo ra các loại phân: photphat, canxi dihidrophotphat, amoni sunfat
+ H2SO4 là một trong những thành phần cần thiết để điều chế thuốc nổ TATP (Triacetone triperoxide)
+ Được sử dụng rộng rãi để khai thác lưu huỳnh từ khí tự nhiên và dầu khí
+ Dùng trong ngành công nghiệp giấy và bột giấy như chất tẩy trắng
+ Axit sunfuric sử dụng trong xử lý nước thải để đưa mức độ pH của nước trở lại bình thường.
Sử dụng Axit sunfuric đúng cách
- Quy tắc sử dụng Axit sunfuric đúng cách
+ Tránh tiếp xúc trực tiếp, hít hoặc uống.
+ Khi sử dụng axit H2SO4 nên pha loãng với nước, nhưng phải đổ axit vào nước chứ không nên đổ nước vào axit vì có thể gây ra phản
ứng cháy nổ bất ngờ.
+ Cần phải mặc quần áo bảo hộ, đi giày, ủng, đeo kính, gang tay đạt chuẩn, tránh tiếp xúc gần.
+ Tuyệt đối không để axit sunfuric rò rỉ ra ngoài môi trường và gặp nước vì H2SO4 có tính háo nước và có thể hòa tận vô tận với nước.
+ Cách ly mọi người khỏi nơi nguy hiểm khi có các hiện tượng rò rỉ axit.
+ Tuân thủ đúng hướng dẫn sử dụng trên nhãn sản phẩm
- Cách bảo quản Axit sunfuric
+ Chứa Axit Sunfuric bằng bồn nhựa, phuy nhựa.
+ Không được đựng trong bồn làm bằng nhôm, thiếc, inox và kẽm bởi nó là một chất ăn mòn kim loại rất mạnh.
+ Đậy nắp kín, đặt nơi khô ráo, tránh xa nơi có chưa bazơ hay các chất khử.
+ Tránh để gần các kim loại, kim loại nhẹ, các chất có tính axít để tránh gây cháy nổ như axit clohiric, axit nitric, acid photphoric, …
Sơ đồ tư duy về Axit sunfuric