

Bạc | Ag (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 20/12/2023
20/12/2023
Bài viết tìm hiểu về Bạc (Ag) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Bạc (Ag): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
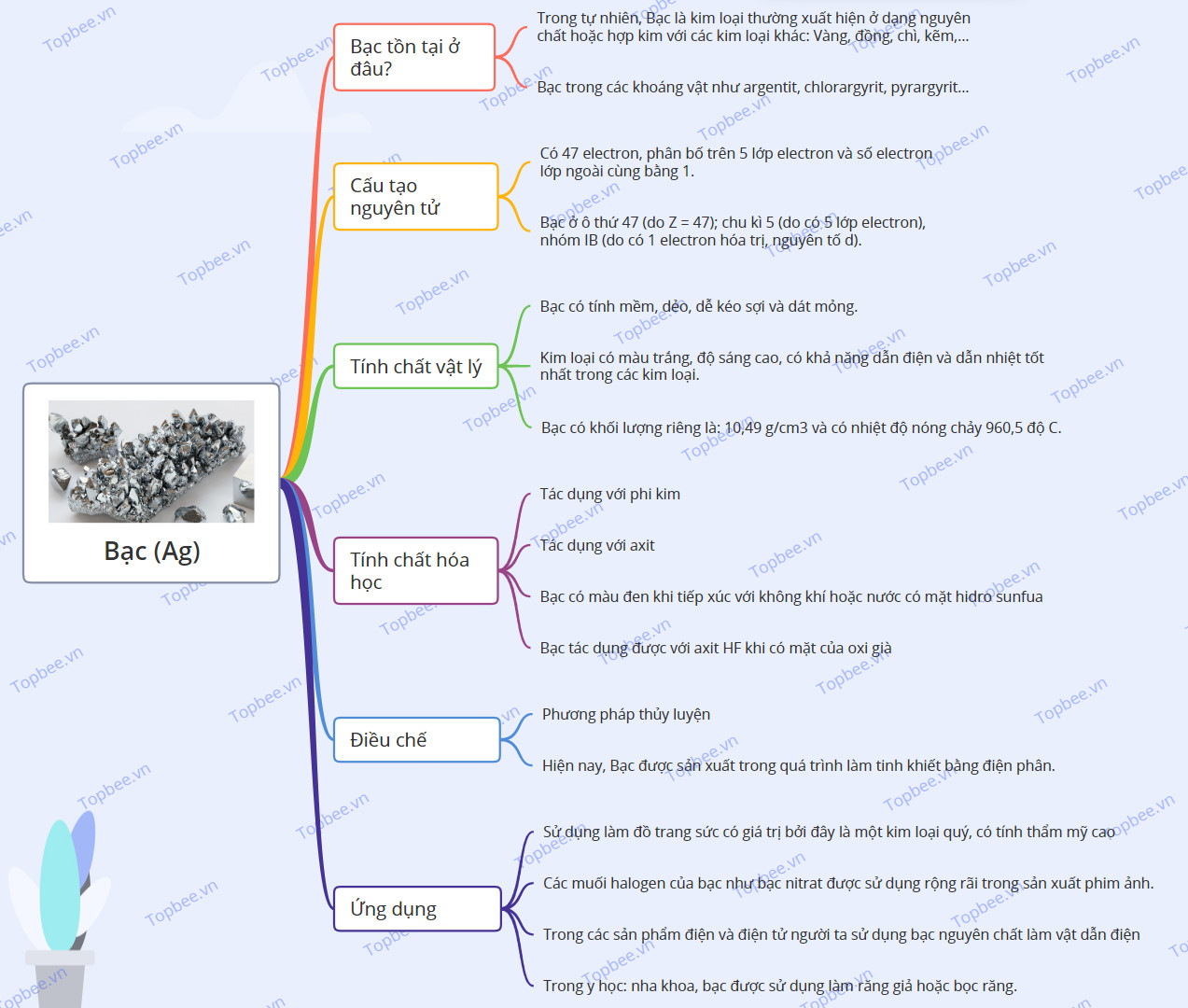
Bạc tồn tại ở đâu?
Bạc là một nguyên tố hóa học có ký hiệu Ag và số hiệu nguyên tử 47.
Trong tự nhiên, Bạc là kim loại thường xuất hiện ở dạng nguyên chất hoặc hợp kim với các kim loại khác: Vàng, đồng, chì, kẽm,…hoặc cũng có thể tìm thấy Bạc trong các khoáng vật như argentit, chlorargyrit, pyrargyrit…
Cấu tạo nguyên tử của bạc
+ Cấu hình electron của Ag là 1s22s22p63s23p63d104s24p64d105s1
=> Nguyên tử Ag có 47 electron, phân bố trên 5 lớp electron và số electron lớp ngoài cùng bằng 1.
=> Bạc ở ô thứ 47 (do Z = 47); chu kì 5 (do có 5 lớp electron), nhóm IB (do có 1 electron hóa trị, nguyên tố d).
+ Là kim loại chuyển tiếp dãy thứ hai.
+ Trong các phản ứng hóa học, bạc có xu hướng nhường 1 electron để đạt cấu hình electron bền hơn.
Tính chất vật lý
- Bạc có tính mềm, dẻo, dễ kéo sợi và dát mỏng.
- Kim loại có màu trắng, độ sáng cao, có khả năng dẫn điện và dẫn nhiệt tốt nhất trong các kim loại.
- Bạc có khối lượng riêng là: 10,49 g/cm3 và có nhiệt độ nóng chảy 960,50C.

Tính chất hóa học
- Kém hoạt động (kim loại quý), nhưng ion Ag+ có tính oxi hóa mạnh, bạc có thế điện cực chuẩn (E0Ag+/Ag= + 0,80V)
a. Tác dụng với phi kim
- Bạc không bị oxi hóa trong không khí dù ở nhiệt độ cao.
Tác dụng với ozon
2Ag + O3 → Ag2O + O2
b. Tác dụng với axit
- Bạc không tác dụng với HCl và H2SO4 loãng, nhưng tác dụng với các axit có tính oxi hóa mạnh, như HNO3 hoặc H2SO4 đặc, nóng.
3Ag + 4HNO3 (loãng) → 3AgNO3 + NO + 2H2O
2Ag + 2H2SO4 (đặc, nóng) → Ag2SO4 + SO2 + 2H2O
c. Tác dụng với các chất khác
- Bạc có màu đen khi tiếp xúc với không khí hoặc nước có mặt hidro sunfua:
4Ag + 2H2S + O2 (kk) → 2Ag2S + 2H2O
- Bạc tác dụng được với axit HF khi có mặt của oxi già:
2Ag + 2HF (đặc) + H2O2 → 2AgF + 2H2O
2Ag + 4KCN (đặc) + H2O2 → 2K[Ag(CN)2] + 2KOH
Phương pháp điều chế hiện nay
* Phương pháp thủy luyện:
- Phương pháp thủy luyện dùng để điều chế các kim loại có độ hoạt động hóa học thấp như Bạc.
- Tiến hành điều chế bạc (Ag) bằng bột kẽm bằng phương pháp thủy luyện.
+ Nghiền nhỏ quặng bạc (Ag2S)
+ Cho hóa chất NaCN để hòa tan quặng bạc => Dung dịch muối phức bạc:
Ag2S + 4NaCN → 2Na[Ag(CN)2] + Na2S
+ Dùng bột kẽm nguyên chất (Zn) để khử ion Ag+.
Zn + 2Na[Ag (CN)2] → Na2[Zn(CN)4] + 2Ag
=> Ta thu được bạc nguyên chất từ quặng bạc sunfua.
- Hiện nay, Bạc được sản xuất trong quá trình làm tinh khiết bằng điện phân.
Ứng dụng
- Bạc được sử dụng làm đồ trang sức có giá trị bởi đây là một kim loại quý, có tính thẩm mỹ cao, được người tiêu dùng yêu thích sử dụng.
- Ứng dụng phổ biến nhất của Bạc: Các muối halogen của bạc như bạc nitrat được sử dụng rộng rãi trong sản xuất phim ảnh.
- Trong các sản phẩm điện và điện tử người ta sử dụng bạc nguyên chất làm vật dẫn điện:
+ Ví dụ: Bảng mạch in được làm từ sơn bạc; bàn phím máy tính, labtop sử dụng các tiếp điểm làm từ bạc.
- Đối với gương chúng cần tính phản xạ cao với ánh sáng nên sử dụng bã để tái chế và mặt sau sẽ được mạ nhôm.
- Trong y học:
+ Lĩnh vực nha khoa, bạc được sử dụng làm răng giả hoặc bọc răng.
+ Ứng dụng trong việc sản xuất các loại dược phẩm và làm chất kháng sinh sinh học.
- Trong hóa học, bạc là chất xúc tác thích hợp cho các phản ứng oxy hóa - khử.
- Bạc dùng để sản xuất que hàn và các loại công tắc điện, pin có dung lượng lớn như pin bạc - kẽm hoặc bạc - cadmi.
- Muối halogen của bạc:
+ Bạc Fulminat: chất nổ mạnh
+ Bạc Chloride: chất kết dính cho các loại kính vì nó trong suốt
+ Bạc iodide: chất tụ mây để gây mưa nhân tạo.
- Trong quả pin đồng hồ: Bạc oxit được sử dụng làm cực dương. Ngoài ra, bạc cũng được dùng làm chất khử trùng nước.
Một số hợp chất
* Bạc clorua: AgCl
- Bạc clorua là hợp chất tạo bởi kim loại bạc với anion Cl-.
- AgCl có mặt tự nhiên trong khoáng vật clorargyrit.
- Là chất rắn, có màu trắng, dẻo, không tan trong nước.
- Khi nóng chảy cho màu nâu vàng, không phân hủy khi đun sôi.
- Bạc clorua được dùng để làm giấy ảnh
- Bạc clorua còn được dùng trong băng gạc và các sản phẩm làm lành vết thương.
* Bạc bromua: AgBr
- Là chất rắn, có màu vàng nhạt, không tan trong nước, dễ bị phân hủy khi có ánh sáng.
- Bạc bromua để trong không khí bị phân hủy khi có ánh sáng, chuyển từ màu vàng nhạt sang màu xám của kim loại bạc.
- Bạc bromua được sử dụng trong công nghệ tráng phim ảnh.
* Bạc nitrat: AgNO3
- Là chất rắn, có màu trắng, tan tốt trong nước, có nhiệt độ nóng chảy là 212 độ C.
- Bạc nitrat được dùng làm chất khởi đầu trong việc tổng hợp các hợp chất bạc khác như khử trùng và tạo màu vàng cho thủy tinh của kính màu.
Sơ đồ tư duy
Một số câu hỏi
Câu 1: Cho m gam Ag tác dụng hoàn toàn với 100 gam dung dịch HNO3 63% thu được khí duy nhất NO2 và dung dịch A có nồng độ HNO3 là 55. Tính m.
Câu 2: Cho các kim loại: Al, Cu, Au, Ag. Kim loại dẫn điện tốt nhất trong các kim loại này là:
A. Ag
B. Au
C. Cu
D. Al
Câu 3: Cho V(ml) dung dịch HCl 0,1M tác dụng vừa đủ với 100ml dung dịch AgNO3 C(M) thấy tạo ra 2,87g kết tủa AgCl hãy tính giá trị V và C.
Câu 4: Nêu hiện tượng xảy ra, giải thích và viết phương trình hóa học của các thí nghiệm sau
a. Nhỏ từ từ dung dịch AgNO3 vào ống nghiệm chứa dung dịch BaCl2
b. Cho giấy quỳ tím ẩm vào bình chứa khí Clo.





