

Beri | Be (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 20/12/2023
20/12/2023
Bài viết tìm hiểu về Beri (Be) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Beri (Be): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
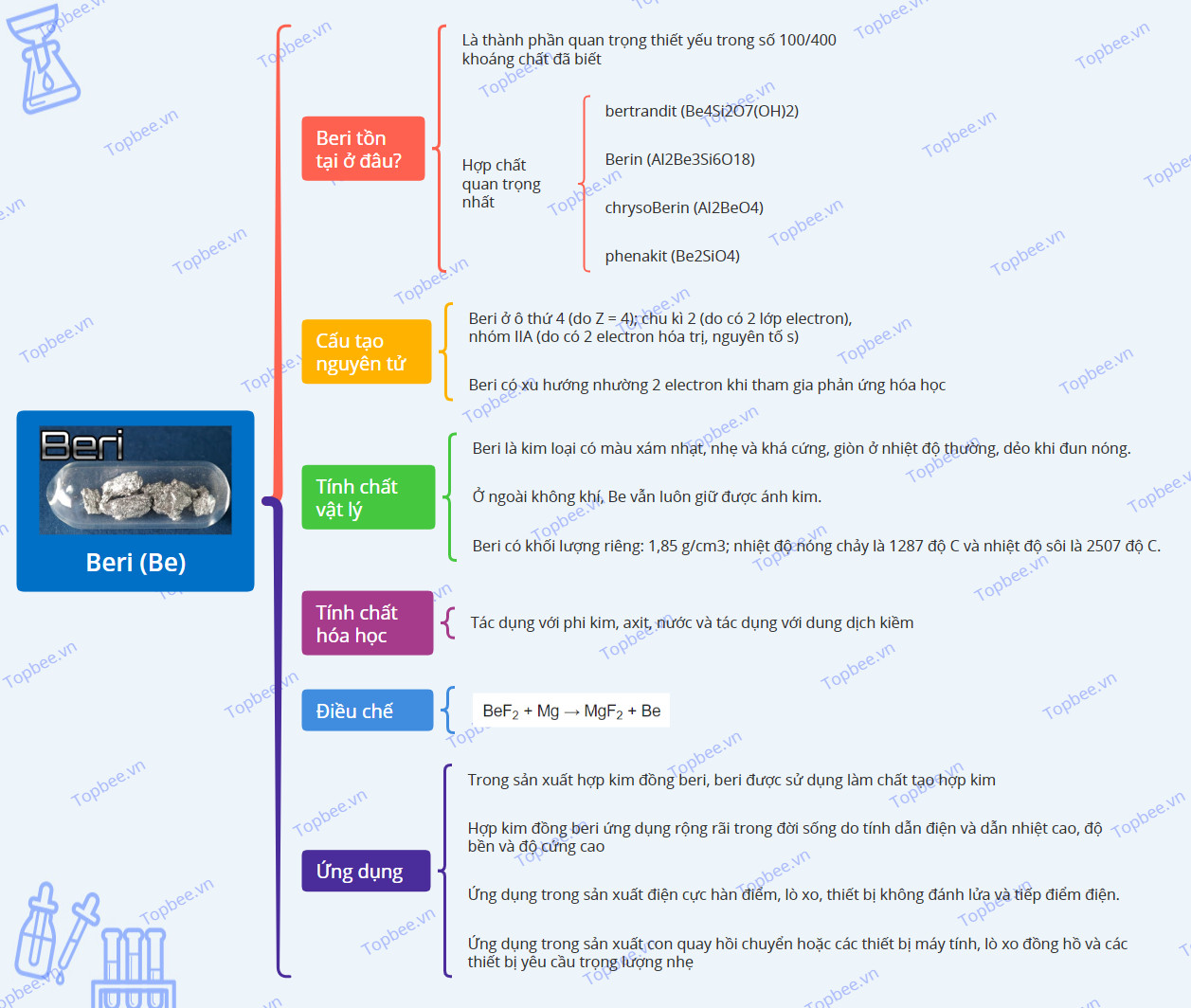
Beri tồn tại ở đâu?
- Beri là nguyên tố hóa học có kí hiệu là Be, nằm ở ô thứ 4, chu kì 2 và nhóm IIA trong bảng tuần hoàn.
- Nguyên tố Be là thành phần quan trọng thiết yếu trong số 100/400 khoáng chất đã biết, hợp chất quan trọng nhất:
+ bertrandit (Be4Si2O7(OH)2)
+ Berin (Al2Be3Si6O18)
+ chrysoBerin (Al2BeO4)
+ phenakit (Be2SiO4)
- Ngọc aquamarin và ngọc lục bảo là các dạng quý hiếm của Beri.
Cấu tạo nguyên tử của Beri
+ Cấu hình electron của Be: 1s22s2
+ Nguyên tử Be có 4 electron, phân bố trên 2 lớp electron và số electron lớp ngoài cùng bằng 2.
+ Beri ở ô thứ 4 (do Z = 4); chu kì 2 (do có 2 lớp electron), nhóm IIA (do có 2 electron hóa trị, nguyên tố s)
+ Be là kim loại.
+ Beri có xu hướng nhường 2 electron khi tham gia phản ứng hóa học để đạt cấu hình bền vững của He.

Tính chất vật lý
- Beri là kim loại có màu xám nhạt, nhẹ và khá cứng, giòn ở nhiệt độ thường, dẻo khi đun nóng.
- Beri có khối lượng riêng: 1,85 g/cm3; nhiệt độ nóng chảy là 12870C và nhiệt độ sôi là 25070C.
- Các hợp chất của beri khi đốt sẽ cho ngọn lửa màu trắng.
- Ở ngoài không khí, Be vẫn luôn giữ được ánh kim.
Tính chất hóa học
- Be là chất khử mạnh nhưng yếu hơn Li và Mg. Trong hợp chất tồn tại dưới dạng ion Be2+.
Be → Be2+ + 2e
a. Tác dụng với phi kim
2Be + O2 → 2BeO
- Trong không khí, Be bị oxi hóa chậm tạo thành màng oxit mỏng bào vệ kim loại, khi đốt nóng Be bị cháy trong oxi.
b. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Be + H2SO4 → BeSO4 + H2
- Với dung dịch HNO3:
3Be + 8HNO3(loãng, nóng) → 3Be(NO3)2 + 2NO + 4H2O
c. Tác dụng với nước
- Ở nhiệt độ thường, Be không phản ứng.
d. Tác dụng với dung dịch kiềm
- Be tác dụng với dung dịch bazơ mạnh
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
Be + 2NaOH n/c → Na2BeO2 + H2
Phương pháp điều chế
Điều chế beri theo phương trình hóa học sau:
BeF2 + Mg → MgF2 + Be
Ứng dụng
- Trong sản xuất hợp kim đồng beri, beri được sử dụng làm chất tạo hợp kim.
+ Hợp kim đồng beri ứng dụng rộng rãi trong đời sống do tính dẫn điện và dẫn nhiệt cao, độ bền và độ cứng cao, đặc biệt là không gây ô nhiễm. Ngoài ra, hợp kim này còn có khả năng chống ăn mòn.
+ Hợp kim đồng beri được sử dụng trong công nghiệp quốc phòng và hàng không vũ trụ: Chúng làm vật liệu kết cấu nhẹ trong máy bay và thiết bị, tốc độ cao, tên lửa, tàu vũ trụ và vệ tinh viễn thông.
- Ứng dụng trong sản xuất điện cực hàn điểm, lò xo, thiết bị không đánh lửa và tiếp điểm điện.
- Beri được sử dụng để tái tạo các mạch tích hợp cực nhỏ trong kỹ thuật in khắc tia X.
- Trong công nghiệp điện hạt nhân: Sử dụng Beri trong các lò phản ứng hạt nhân làm chất phản xạ neutron, bộ điều chỉnh do tỷ lệ hấp thụ neutron nhiệt trên diện tích vuông thấp.
- Ứng dụng trong sản xuất con quay hồi chuyển hoặc các thiết bị máy tính, lò xo đồng hồ và các thiết bị yêu cầu trọng lượng nhẹ, độ cứng và ổn định kích thước.
Một số hợp chất
* Beri oxit: BeO
+ Là chất rắn có màu trắng dạng bột, không tan trong nước và nóng chảy ở nhiệt độ 2507oC.
+ Thạch anh BeO là một loại gốm rất ổn định. BeO còn được ứng dụng trong động cơ tên lửa.
+ Ngoài ra, BeO còn được sử dụng trong nhiều bộ phận bán dẫn hiệu suất cao cho các ứng dụng như thiết bị vô tuyến vì nó có tính dẫn nhiệt tốt trong khi cũng là một chất cách điện tốt.
* Beri cacbonat
+ Là một hợp chất vô cơ với thành phần chính là nguyên tố beri và nhóm cacbonat, có công thức hóa học được quy định là BeCO3.
+ Muối trắng này không ổn định
+ Beri cacbonat có thể gây kích ứng, hợp chất này phải được xử lý cẩn thận vì một số hợp chất beri liên quan được biết chất gây ung thư
* Beri hidroxit: là một hợp chất hóa học có công thức là Be(OH)2
+ Là bột hoặc tinh thể màu trắng
+ Beri hidroxit là một hidroxit lưỡng tính, hòa tan trong cả axit và kiềm.
* Beri sunfat: BeSO4
+ Beri sulfat là một hợp chất vô cơ, tinh thể, màu trắng, phát ra khói độc của oxit beri và oxit lưu huỳnh khi đun nóng.
+ sulfat được dùng chủ yếu được sử dụng để sản xuất bột beri oxit cho gốm sứ.
Sơ đồ tư duy
Một số câu hỏi
Câu 1: Beri có tác dụng với nước không?
Câu 2: Be(beri) có phản ứng với HCl không?
Câu 3: Be, BeO, Be(OH)2 đều tác dụng được với dung dịch HCl và dung dịch NaOH. Các chất có tính chất lưỡng tính là
A. Be và Be(OH)2.
B. Be và BeO.
C. Be, BeO và Be(OH)2.
D. BeO và Be(OH)2.
Câu 4: Một thuốc thử phân biệt 3 chất rắn Mg, Be, BeO đựng trong các lọ riêng biệt là dung dịch
A. H2SO4 đặc nguội
B. NaOH.
C. HCl đặc.
D. NH3.
Câu 5: Nêu tính chất hóa học của Beri. Viết các phương trình phản ứng.





