

Cacbon | C (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 25/12/2023
25/12/2023
Bài viết tìm hiểu về Cacbon (C) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Cacbon (C): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
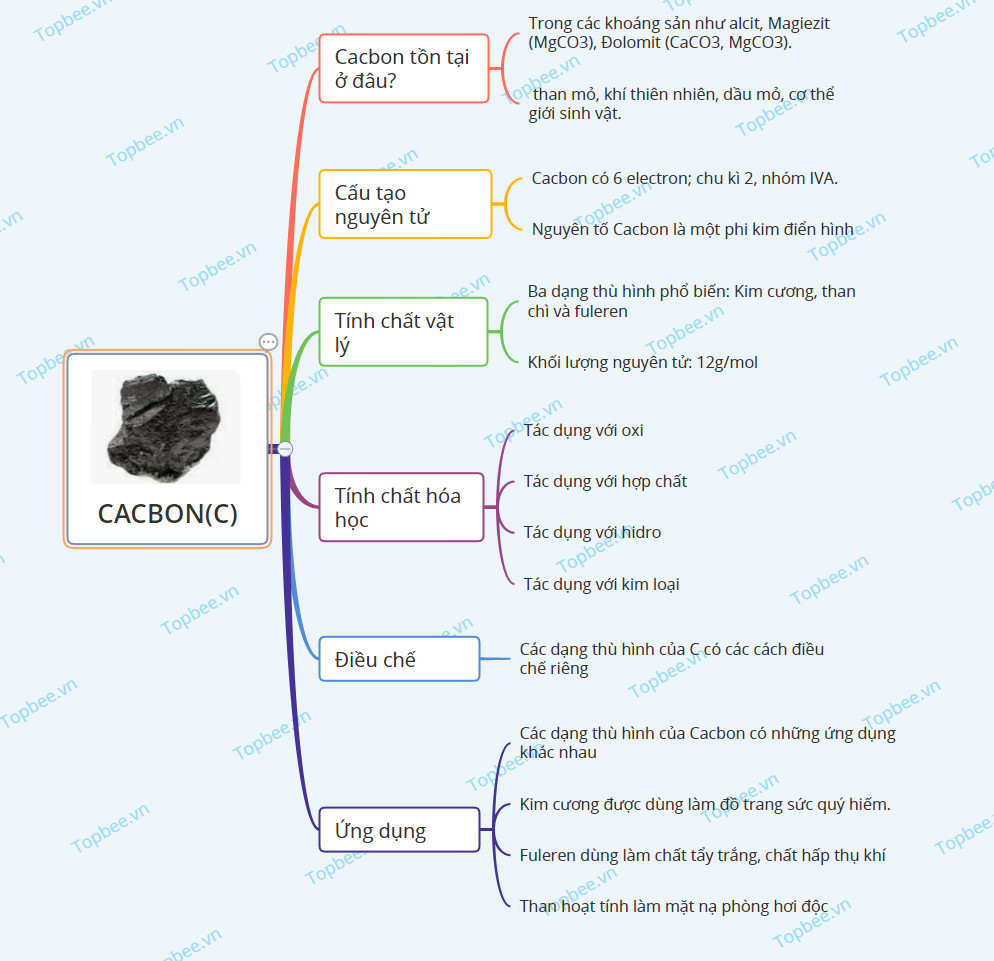
Cacbon tồn tại ở đâu?
+ Cacbon là nguyên tố hóa học ký hiệu là C và có số hiệu nguyên tử là 6 trong bảng tuần hoàn hóa học

+ Phân bố rộng rãi trong tự nhiên:
- Trong các khoáng sản như Calcit (đá vôi, đá phấn, đá hoa,…), Magiezit (MgCO3), Đolomit (CaCO3, MgCO3) .
- Cacbon là thành phần chính của than mỏ, khí thiên nhiên, dầu mỏ, cơ thể giới sinh vật.
+ Nước ta có mỏ than antraxit lớn ở Quảng Ninh, một số mỏ than nhỏ hơn ở Thanh Hóa, Nghệ An, Quảng Nam, ...
Cấu tạo nguyên tử Cacbon
+ Cấu hình e nguyên tử cacbon là 1s22s22p2. Viết gọn: [He]2s2 2p2
+ Cacbon có 6 electron, chu kì 2, nhóm IVA.
+ Nguyên tố Cacbon là một phi kim điển hình.
+ Cấu trúc nguyên tử Cacbon là một trong những cấu trúc cơ bản của các hợp chất hữu cơ.
Tính chất vật lý
+ Cacbon có ba dạng thù hình phổ biến: Kim cương, than chì và fuleren.
- Kim cương: là tinh thể trong suốt, không màu, không dẫn điện, rất cứng.
- Than chì: là tinh thể xám đen, dẫn điện tốt, có ánh kim
- Fuleren (Cacbon vô định hình): hấp phụ mạnh các chất khí và chất tan trong dung dịch.
+ Nguyên tử khối: 12 g/mol.
+ Độ âm điện: 2,5
+ Điểm sôi: 4827 độ C.
+ Điểm nóng chảy: 3652 độ C.
+ C có ba đồng vị: 12C, 13C, 14C
Tính chất hóa học
Trong các phản ứng oxi hóa - khử, đơn chất cacbon có thể tăng hoặc giảm số oxi hóa, nên nó thể hiện tính khử hoặc tính oxi hóa.
Tuy nhiên, tính khử vẫn là tính chất chủ yếu của cacbon.
* Tính khử
a. Tác dụng với oxi
+ Cacbon cháy trong không khí tạo CO2 và giải phóng cả CO, phản ứng tỏa nhiều nhiệt:
b. Tác dụng với hợp chất
+ Cacbon có thể khử được nhiều oxit ở nhiệt độ cao
+ Phản ứng với nhiều chất oxi hóa khác như HNO3, H2SO4 đặc, KClO3,...
* Tính oxi hóa
a. Tác dụng với hiđro
+ C tác dụng với khí H2 tạo thành CH4 ở nhiệt độ cao và có chất xúc tác:
b. Tác dụng với kim loại
+ Ở nhiệt độ cao, C tác dụng được với một số kim loại tạo thành cacbua kim loại.
Ứng dụng
Cacbon có ứng dụng đa dạng:
+ Kim cương được dùng làm đồ trang sức quý hiếm.
+ Than chì được ứng dụng trong nồi nấu kim loại ở nhiệt độ cao, điện cực đèn hồ quang, tế bào khô hoặc cho đầu bút chì, các vật liệu có
khả năng chịu lửa, chất bôi trơn…

+ Cacbon vô định hình được dùng làm chất tẩy trắng, chất hấp thụ khí
+ Than hoạt tính làm mặt nạ phòng hơi độc…
+ Than đá, than gỗ…làm chất đốt

+ Đồng vị Cacbon-14 dùng xác định niên đại vì có tính phóng xạ
+ Cacbon monoxide rất hữu ích cho việc khử trong một số quy trình luyện kim.
+ Cacbon disulphide và cacbon tetrachloride là nguyên liệu sản xuất dung môi
Điều chế
Các dạng thù hình của Cacbon có các cách điều chế khác nhau:
+ Kim cương: nung than chì ở trong nhiệt độ khoảng 2.000 độ C, áp suất 50 đến 100 nghìn atm, có chất xúc tác sắt, niken hoặc crom.
+ Than cốc: Nung than mỡ trong lò không có không khí, lò luyện cốc ở nhiệt độ cao khoảng 2.000 độ C.
+ Than chì được tạo ra bằng cách nung than cốc trong nhiệt độ trong khoảng 2.500 - 3.000 độ C trong lò điện với điều kiện không có không
khí.
+ Đốt gỗ trong điều kiện thiếu không khí sẽ thu được than gỗ.
+ Than muội: Khi nhiệt phân metan ở điều kiện nhiệt độ và xúc tác thích hợp
+ Than mỏ được khai thác trực tiếp từ các vỉ than nằm sâu dưới mặt đất.
Một số hợp chất
*Carbon monooxit: CO
- Là chất khí không màu, không mùi, không vị, ít tan trong nước, bền với nhiệt và rất độc.
- CO là oxit trung tính, kém hoạt động ở nhiệt độ thường, hoạt động nhiều hơn khi đun nóng
*Carbon dioxit: CO2
- Là chất khí, không màu nặng hơn không khí, ít tan trong nước.
- Khí CO2 hóa thành khối rắn khi làm lạnh đột ngột ở -76oC, còn gọi là nước đá khô.
*Axit carbonic: CO2
- Là axit kém bền, chỉ tồn tại trong dung dịch loãng
- Dễ bị phân hủy thành CO2 và H2O.
*Muối cacbonat
- Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan tốt trong nước
- Muối cacbonat của các kim loại còn lại không tan, muối hidrocacbonat kếm bền nên dễ bị nhiệt phân
Sơ đồ tư duy về Cacbon
Một số câu hỏi về Cacbon và hợp chất của Cacbon
Câu 1: Điều nào sau đây không đúng cho phản ứng của khí CO và O2?
A. Phản ứng thu nhiệt.
B. Phản ứng tỏa nhiệt.
C. Phản ứng kèm theo sự giảm thể tích.
D. Phản ứng không xảy ra ở điều kiện thường
Câu 2: Trên bề mặt hồ nước tôi vôi lâu ngày thường có lớp màng chất rắn. Hãy giải thích hiện tượng này và viết phương trình hóa học.
Câu 3: Dẫn 1,12 lít hỗn hợp khí gồm CO, H2 vừa đủ qua bột Đồng (II) oxit nung ở nhiệt độ cao. Khối lượng Đồng thu được sau phản ứng là
A. 2,0 gam.
B. 1,2 gam.
C. 3,2 gam.
D. 4,2 gam.
Câu 4: Để tạo xốp cho một số loại bánh, có thể dùng muối nào sau đây?
A. (NH4)3PO4.
B. NH4HCO3.
C. CaCO3.
D. NaCl.
Câu 5: Trong công nghiệp, người ta sử dụng carbon để làm nhiên liệu. Tính nhiệt lượng toả ra khi đốt cháy 5 kg than chứa 90% carbon,
biết 1 mol carbon cháy toả ra 394 kJ.





