

Clo | Cl (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 25/12/2023
25/12/2023
Bài viết tìm hiểu về Clo (Cl) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Clo (Cl): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học
Clo tồn tại ở đâu?
- Clo là nguyên tố hóa học có ký hiệu Cl và có số hiệu nguyên tử là 17 trong bảng tuần hoàn nguyên tố hóa học.
- Trong tự nhiên, Clo tồn tại ở dạng hợp chất:
+ Chủ yếu ở dạng muối clorua, quan trọng nhất là NaCl (NaCl có trong nước biển và đại dương
+ Clo cũng khá phổ biến trong khoáng vật cacnalit KCl.MgCl2.6H2O và xinvinit NaCl.KCl.
Cấu tạo nguyên tử
+ Cấu hình electron: 1s22s22p63s23p5
+ Nguyên tử Clo có 17 electron, chu kì 3, nhóm VIIA.
+ Clo là nguyên tố phi kim thuộc nhóm Halogen trong bảng tuần hoàn.
+ Nguyên tố Clo thường tồn tại ở phân tử dạng 2 nguyên tử (Cl2).
Tính chất vật lý
+ Clo là chất khí, có màu vàng lục và có mùi hắc.
+ Phi kim này vô cùng độc hại.
+Nguyên tử khối: 17 g/mol, Cl nặng hơn nhiều so với không khí.
+ Khí Clo là một khí có khả năng phản ứng ngay lập tức gần như với mọi nguyên tố.
+ Clo có thể hóa lỏng ở nhiệt độ phòng với áp lực trên 8 atm.
Tính chất hóa học
Clo là phi kim hoạt động mạnh.
*Tác dụng với kim loại
+ Clo có thể tác dụng với hầu hết kim loại tạo thành muối clorua.
2Fe + 3Cl2 → 2FeCl3
Mg + Cl2 → MgCl2
- Clo có thể thể tác dụng với kim loại sắt tạo thành sắt (III) clorua, tác dụng với kim loại magie tạo thành magie (II) clorua:
*Tác dụng với hidro
- Khí Clo dễ dàng phản ứng với hidro tạo thành khí hidro clorua.
H2 + Cl2 → 2HCl
- Khí HCl tan nhiều trong nước tạo thành dung dịch axit clohidric HCl.
Lưu ý: Clo không phản ứng trực tiếp với oxi.
*Tác dụng với nước
+ Dung dịch nước Clo làm đổi màu quỳ tím thành đỏ sau đó lại mất ngay.
H2O + Cl2 ↔ HCl + HClO
+ Phản ứng Clo với nước xảy ra theo 2 chiều ngược nhau.
+ Nước Clo là hỗn hợp các chất: Cl2, HCl, HCLO nên có màu vàng lục, mùi hắc của khí Clo.
+ Quỳ tím chuyển màu đỏ và nhanh chóng bị mất đi do tác dụng oxi hóa mạnh của HClO (axit hipoclorơ).
*Tác dụng với NaOH
+ Dẫn khí clo vào ống nghiệm đựng NaOH.
+ Tiếp tục nhỏ 1-2 giọt dung dịch vừa tạo thành vào quỳ tím.
+ Quan sát hiện tượng ta thấy dung dịch tạo thành không có màu và giấy quỳ tím mất màu.
+ Phương trình phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O
- Ở phản ứng trên: Dung dịch hỗn hợp của 2 muối natri clorua (HCl) và natri hipoclorit (NaClO) được gọi là nước Gia-ven. Đây là dung dịch
có tính tẩy màu, tương tự như HClO và NaClO là chất oxi hóa mạnh.
*Tác dụng với muối
Khi cho Clo tác dụng với muối, nó sẽ khử hỗn hợp muối ban đầu thành muối Clorua.
2NaBr + Cl2 → 2NaCl + Br2
Điều chế
*Trong phòng thí nghiệm
- Quy trình điều chế khí clo trong PTN
4HCl (đặc) + MnO2 (đun nhẹ) → MnCl2 + Cl2 + 2H2O
16HCl (đặc) + 2KMnO4 (đun nhẹ) → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
+ Cho dung dịch HCl đậm đặc tác dụng với các chất oxi hóa mạnh như MnO2, KMnO4…
+ Khí Cl2 được làm khô bằng H2SO4 đặc và thu vào bình bằng cách đẩy không khí.
*Trong công nghiệp
Trong công nghiệp, khí clo được điều chế bằng cách điện phân dung dịch NaCl có màng ngăn xốp.
2NaCl + 2H2O điện phân dd có màng ngăn → Cl2 + H2 + 2NaOH
Khí Cl2 thu được ở cực âm (–)
Khí H2 thu được ở cực dương (+)
Ứng dụng
+ Clo được dùng để khử trùng và làm sạch trong xử lý nước, sản xuất chất tẩy rửa, chất tẩy,..
+ Trong quá trình xử lý chất thải, sử dụng Clo để khử trùng và giảm sự ô nhiễm vi sinh
+ Khử trùng các bề mặt, dụng cụ y tế và trong quá trình xử lý nước y tế
+ Làm sạch thiết bị và nước trong quá trình sản xuất và chế biến thực phẩm.
+ Clo dùng để tẩy trắng sợi giấy trong quá trình sản xuất giấy, giúp tạo ra giấy trắng và sạch.
+ Người ta sử dụng Clo để tiêu diệt vi khuẩn và đảm bảo nước hồ bơi luôn trong điều kiện sạch và an toàn cho người sử dụng
Một số hợp chất
*Hidroclorua: HCl
- Là chất khí không màu, mùi xốc, nặng hơn không khí
- Tan nhiều trong nước tạo thành dung dịch axit clohidric.
* Muối của Clo:
- Muối clorua dễ tan trong nước: NaCl, MgCl2, BaCl2, ....
- Một số muối clorua không tan trong nước: AgCl, PbCl2, CuCl, Hg2Cl2 (PbCl2 tan khá nhiều trong nước nóng)
* Axit có oxi của clo: HClO, HClO2, HClO3, HClO4.
* Nước Gia-ven:
- Là hỗn hợp của NaCl và NaClO.
- Là muối của axit rất yếu, nhưng có tính oxi hóa mạnh được dùng để tẩy trắng, sát trùng,..
* Clorua vôi: CaOCl2
- Là muối hỗn tạp, có tính oxi hóa mạnh
- Clorua vôi cũng dùng để tẩy trắng, tẩy uế.
- So với nước Gia-ven, clorua vôi rẻ tiền hơn, dễ bảo quản và dễ vận chuyển hơn.
* Muối Kali clorat: KClO3
- Dùng chế tạo thuốc nổ, sản xuất pháo hoa, ngòi nổ
- Dùng trong công nghiệp diêm
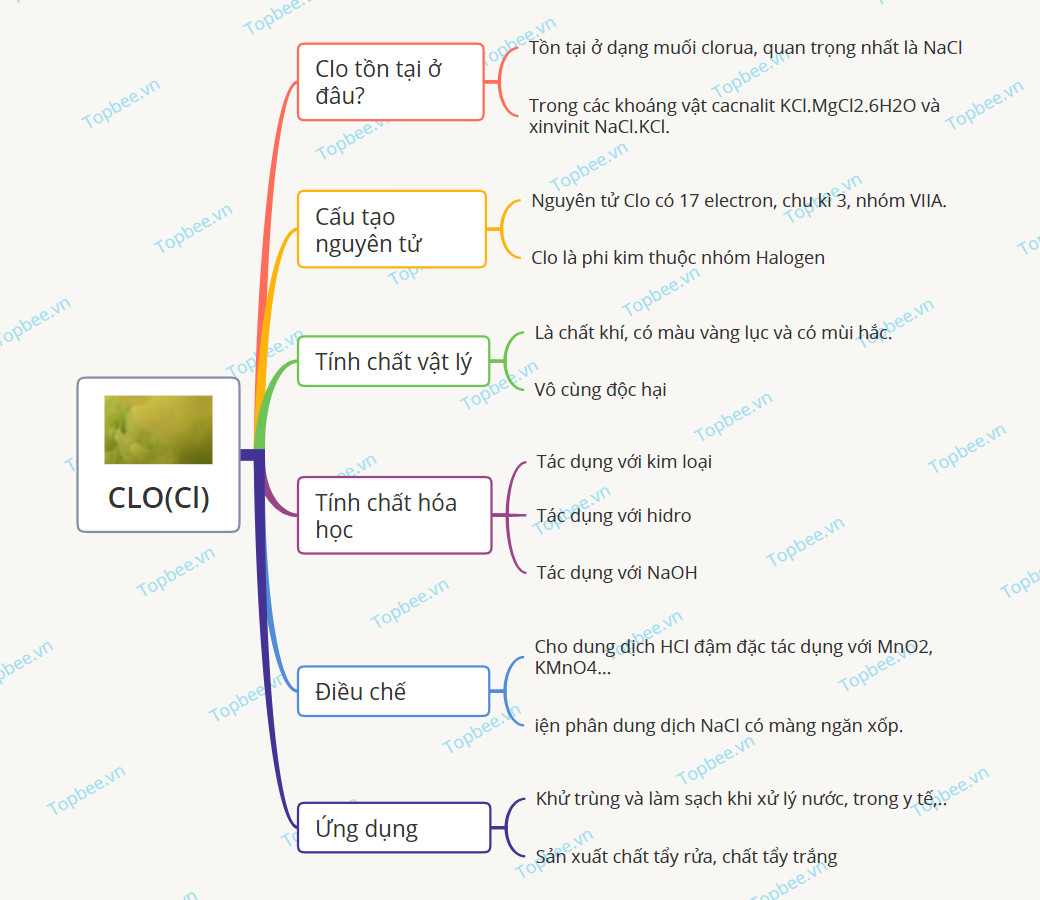
Sơ đồ tư duy về Clo
Một số câu hỏi về Clo và hợp chất của Clo
Câu 1: Sau khi làm thí nghiệm, khí clo dư được loại bỏ bằng cách sục khí clo vào:
a) Dung dịch HCl
b) Dung dịch NaOH
c) Dung dịch NaCl
d) Nước
Trường hợp nào đúng? Hãy giải thích.
Câu 2: Có 4 lọ đựng 4 khí riêng biệt: oxi, hiđro, clo và khí cacbonic. Bằng cách nào trong các cách sau đây để phân biệt mỗi khí trên (tiến
hành theo trình tự sau):
A. Dùng nước vôi trong dư
B. Dùng nước vôi trong dư, sau đó dùng quì tím ẩm
C. Dùng tàn đom đóm, sau đó dùng quỳ tím ẩm
D. Dùng quì tím ẩm, sau đó dùng nước vôi trong
Câu 3: Cho 10,44 g MnO2 tác dụng axit HCl đặc, dư. Khí sinh ra (đktc) cho tác dụng vừa đủ với dung dịch NaOH 2M.
Tính thể tích dung dịch NaOH đã phản ứng.
Câu 4: Trong công nghiệp, clo được điều chế bằng phương pháp gì?
A. Điện phân dung dịch
B. Thủy phân
C. Nhiệt phân
D. Điện phân nóng chảy
Câu 5: Viết các phương trình phản ứng xảy ra cho các sơ đồ sau:
a. HCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl
b. KMnO4 → Cl2 → HCl → FeCl3 → AgCl→ Cl2→ Br2 → I2
c. KMnO4 → Cl2 → HCl → FeCl2 → AgCl → Ag





