

Crom | Cr (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Crom (Cr) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Crom (Cr): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
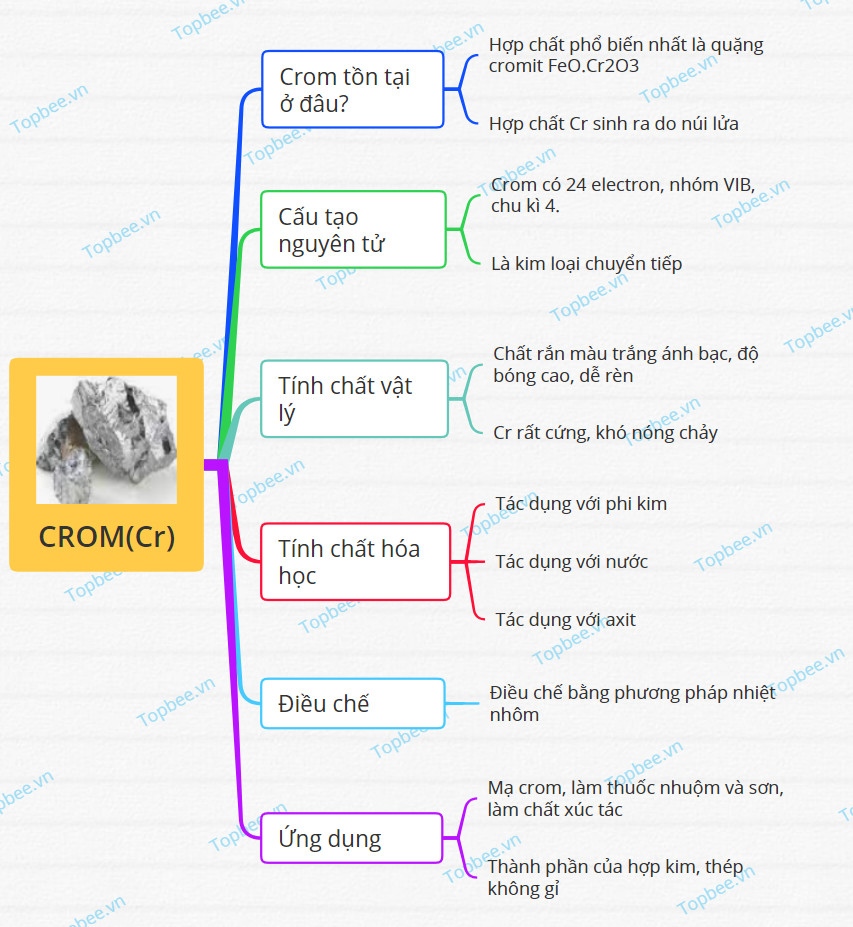
Crom tồn tại ở đâu?
- Crom là nguyên tố hóa học kí hiệu là Cr và có số hiệu nguyên tử là 24 trong bảng tuần hoàn hóa .
- Crom là nguyên tố phổ biến thứ 21 trong vỏ Trái Đất chiếm 0,03% khối lượng.
-Trong tự nhiên Crom tồn tại ở dạng hợp chất:
+ Hợp chất phổ biến nhất là quặng cromit FeO.Cr2O3
+ Các hợp chất crom được tìm thấy trong môi trường do sự bào mòn các đá chứa crom và có thể được cung cấp từ nguồn núi lửa.
Cấu tạo nguyên tử
- Cấu hình e: 1s22s22p63s23p63d54s1 hay [Ar]3d54s1 .
- Crom có 24 electron, nhóm VIB, chu kì 4.
- Là kim loại trong nhóm kim loại chuyển tiếp.
- Trong hợp chất, crom có số OXH biến đổi từ +1 đến +6. Phổ biến hơn cả là các số oxi hóa: +2, +3, +6
- Ở nhiệt độ thường, crom có cấu tạo mạng tinh thể lập phương tâm khối
- Ba đồng vị ổn định: 53Cr, 54Cr và 52Cr là phổ biến nhất (83,789%).
Tính chất vật lý
- Crom có màu trắng ánh bạc, độ bóng cao, dễ rèn

- Crom rất cứng, độ cứng chỉ đứng sau kim cương.
- Khối lượng nguyên tử : 52 g/mol
- Crom khó nóng chảy, nhiệt độ nóng chảy ở 1890 độ C.
- Là kim loại nặng, có khối lượng riêng là 7,2 g/cm3.
Tính chất hóa học
- Là kim loại có tính khử mạnh hơn sắt.
- Trong các hợp chất crom có số oxi hoá từ +1 → +6 (hay gặp +2, +3 và +6).
*Tác dụng với phi kim
- Ở nhiệt độ thường, crom chỉ tác dụng với flo. Ở nhiệt độ cao, crom tác dụng với oxi, clo, lưu huỳnh,...
4Cr + 3O2 → 2 Cr2O3
2Cr + 3Cl2 → 2 CrCl3
- Ở nhiệt độ thường trong không khí, kim loại crôm tạo ra màng mỏng crôm (III) oxit có cấu tạo mịn, bền vững bảo vệ.
- Ở nhiệt độ cao khử được nhiều phi kim.
*Tác dụng với nước
Crom có độ hoạt động hóa học kém Zn và mạnh hơn Fe, nhưng crom bền với nước và không khí do có màng oxit rất mỏng, bền bảo vệ.
Do đó, người ta mạ crom lên sắt để bảo vệ sắt và dùng crom để chế thép không gỉ.
*Tác dụng với dung dịch axit
- Trong dung dịch HCl và H2SO4 loãng nóng, màng axit sẽ bị phá hủy, crom sẽ khử ion H+ tạo ra muối Cr(II) và khí hiđro.
+ Phương trình hóa học:
Cr + H2SO4 → CrSO4 + H2
- Crom không tác dụng với HNO3 và H2SO4 đặc nguội.
- Tác dụng với HNO3 loãng, đặc nóng và H2SO4 đặc nóng
+ Phương trình hóa học:
Cr + 4HNO3 → Cr(NO3)3 + NO + 2H2O
Điều chế
- Phương pháp: crom được điều chế bằng phương pháp nhiệt nhôm.
- Oxit crom (Cr2O3) được tách ra từ quặng theo phương trình hóa học:
Cr2O3 + 2Al → 2Cr + Al2O3
Ứng dụng
- Các công dụng của crom và hợp chất của crom:
+ Tăng cườg khả năng chống ăn mòn và đánh bóng bề mặt trong luyện kim.
+ Các muối crom được sử dụng trong quá trình thuộc da.
+ Là một thành phần của hợp kim, trong thép không gỉ để làm dao, kéo.
+ Mạ crom, làm thuốc nhuộm và sơn, làm chất xúc tác.
+ Cromit được sử dụng làm khuôn để nung gạch, ngói.
+ Dicromat kali (K2Cr2O7)là một thuốc thử hóa học.
+ Hợp chất Crom (III) ứng dụng trong ngành y tế như dùng cho người cần giảm cân hoặc mắc các bệnh mãn tính như tiểu đường
Một số hợp chất
*Crom(II) oxit: CrO
- Màu đen, nó thường tồn tại dưới dạng chất rắn.
- Mang đầy đủ tính chất của oxit bazo, có tính khử
- CrO dễ bị oxi hóa thành Cr2O3 trong không khí.
*Crom (II) hidroxit – Cr(OH)2
- Là chất rắn, màu vàng.
- Cr(OH)2 là một bazơ có tính khử, trong không khí oxi hóa thành Cr(OH)3
* Muối crom(II): CrCl2
- Muối crom (II) có tính khử mạnh, có màu xanh lam khi để ngoài không khí.
- Khi ở dạng dung dịch CrCl2 sẽ chuyển từ màu xanh lam sang màu xanh lục
*Crom(III) oxit: Cr2O3
- Là chất rắn, màu lục thẫm, không tan.
- Cr2O3 là oxit lưỡng tính tương tự Al2O3:
* Hidroxit Cr(OH)3
- Là một kết tủa nhầy, màu lục nhạt
- Cr(OH)3 là một hidroxit lưỡng tính tan được trong dung dịch axit và dung dịch kiềm.
* Muối crom (III): CrCl3
- Là chất rắn kết tinh có tính ăn mòn cao
- Dạng khan là chất rắn màu tím
- Dạng phổ biến có màu xanh lam hoặc xanh lục đến đen.
- Trong môi trường axit, muối crom(III) có tính oxi hoá và bị khử:
2CrCl3 + Zn → 2CrCl2 + ZnCl2
Cr2(SO4)3 + Zn → 2CrSO4 + ZnSO
- Trong môi trường kiềm, muối crom(III) có tính khử và bị oxi hóa:
2CrBr3 + 3Br2 + 16KOH → 2K2CrO4 + 12KBr + 8H2O
Cr2(SO4)3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 3K2SO4 + 8H2O
- Nó được sử dụng làm chất xúc tác và tiền chất sản xuất thuốc nhuộm len.
Sơ đồ tư duy về
Một số câu hỏi về Crom và hợp chất của Crom
Câu 1: Để oxi hóa hoàn toàn 0,01 mol CrCl3 thành K2CrO4 bằng Cl2 khi có mặt KOH, lượng mol tối thiểu Cl2 và KOH phản ứng là
A. 0,03 và 0,08
B. 0,015 và 0,08
C. 0,03 và 0,04
D. 0,015 và 0,04
Câu 2: Cho dung dịch NaOH từ từ đến dư vào dung dịch CrCl3 sẽ có hiện tượng là
A. xuất hiện kết tủa keo trắng không tan.
B. xuất hiện kết tủa keo trắng sau đó tan dần
C. xuất hiện kết tủa lục xám không tan.
D. xuất hiện kết tủa lục xám sau đó tan dần
Câu 3: Cho phản ứng: Zn + 2Cr3+ → Zn2+ + 2Cr2+
Nhận định nào sau đây đúng ?
A. Zn có tính khử yếu hơn Cr2+ và Cr3+ có tính oxi hóa yếu hơn Zn2+.
B. Zn có tính khử mạnh hơn Cr2+ và Cr3+ có tính oxi hóa mạnh hơn Zn2+.
C. Zn có tính oxi hóa yếu hơn Cr2+ và Cr3+ có tính khử yếu hơn Zn2+.
D. Zn có tính oxi hóa mạnh hơn Cr2+ và Cr3+ có tính khử mạnh hơn Zn2+
Câu 4: Cho các phát biểu sau:
(a) Trong bảng tuần hoàn các nguyên tố hóa học, crom thuộc chu kì 4, nhóm VIB.
(b) Các oxit của crom đều là oxit bazơ.
(c) Trong các hợp chất, số oxi hóa cao nhất của crom là +6
(d) Trong các phản ứng hóa học, hợp chất crom(III) chỉ đóng vai trò chất oxi hóa.
(e) Khi phản ứng với khí Cl2 dư, crom tạo ra hợp chất crom(III).
Trong các phát biểu trên, những phát biểu đúng là:
A. (a), (b) và (e)
B. (a), (c) và (e)
C. (b), (d) và (e)
D. (b), (c) và (e)
Câu 5: Cho m gam hỗn hợp bột X gồm ba kim loại Zn, Cr, Sn có số mol bằng nhau tác dụng hết với lượng dư dung dịch HCl loãng, nóng
thu được dung dịch Y và khí H2. Cô cạn dung dịch Y thu được 8,98 gam muối khan. Nếu cho m gam hỗn hợp X tác dụng hoàn toàn với
O2 (dư) để tạo hỗn hợp 3 oxit thì thể tích khí O2 (đktc) phản ứng là
A. 2,016 lít.
B. 1,008 lít.
C. 0,672 lít.
D. 1,344 lí





