CuSO4 (kết tủa không, điện ly mạnh hay yếu, mindmap)
 11/1/2024
11/1/2024
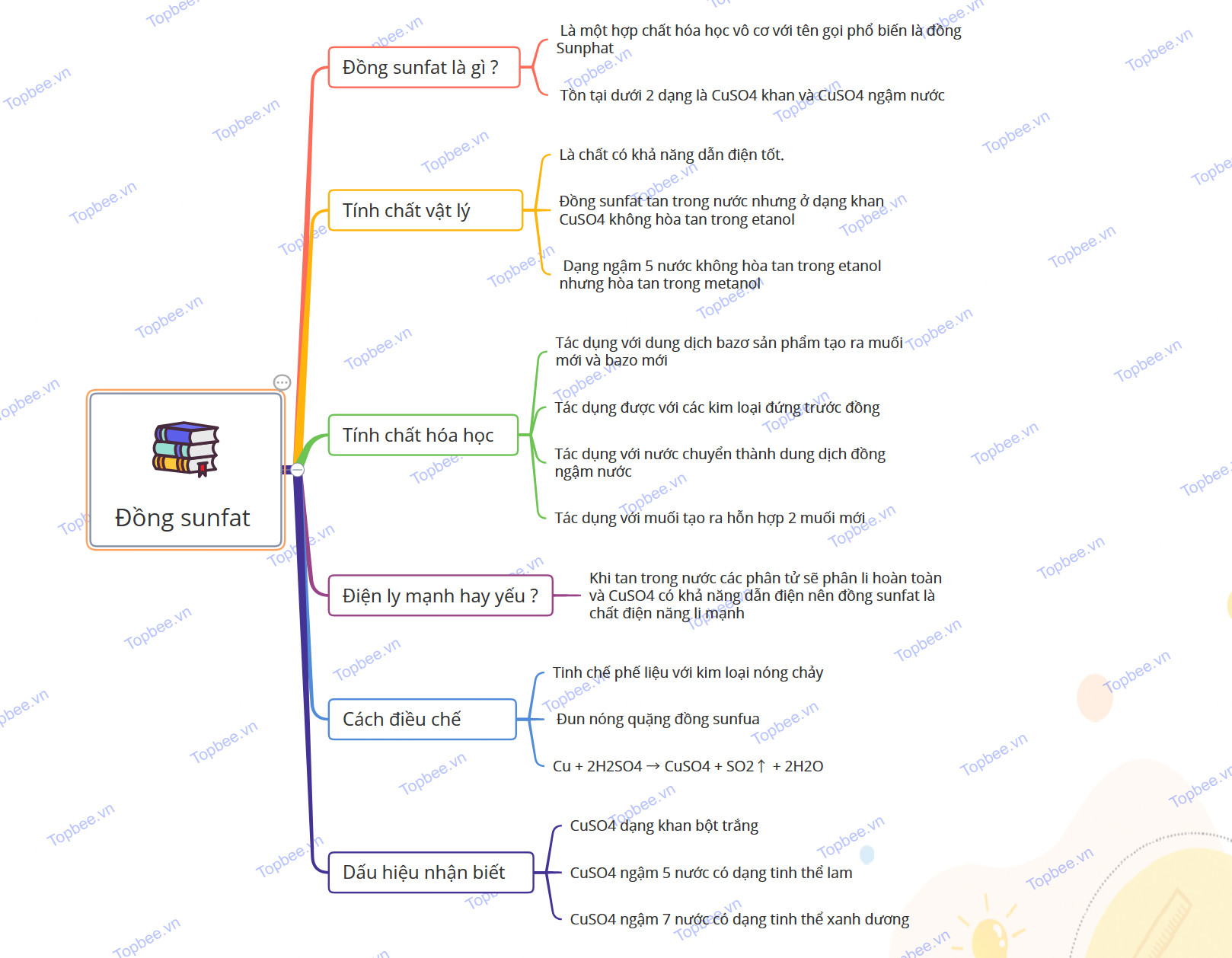
Tổng hợp kiến thức về CuSO4: Cấu tạo phân tử, Tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp học sinh ôn tập, bổ sung kiến thức.
Đồng sunfat (CuSO4) là gì ?
- Khái niệm: Đồng sunfat là một hợp chất hóa học vô cơ với tên gọi phổ biến là đồng Sunphat, có công thức hóa học được ký hiệu là CuSO4.
- CuSO4 mang nhiều tên khác như Xanh vitriol, Salzburg vitriol, Roman vitriol, Xanh đồng hoặc Đá xanh.
Cấu tạo phân tử:
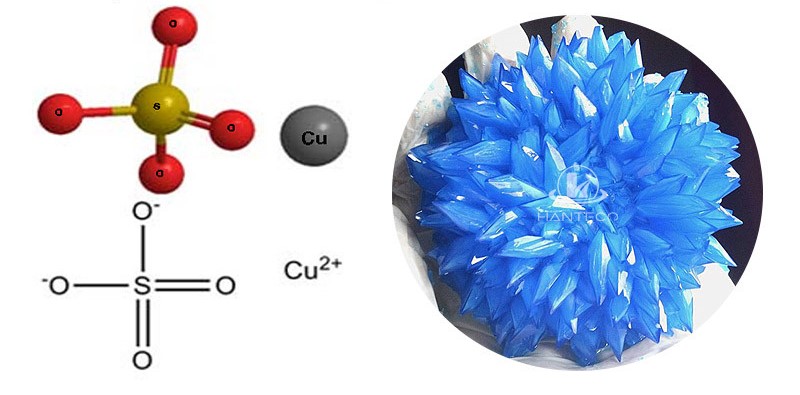
- Đồng sunfat tồn tại dưới 2 dạng là CuSO4 khan và CuSO4 ngậm nước:
+ Với CuSO4 khan: CuSO4 khan không có sẵn trong tự nhiên và tồn tại ở dạng bột có màu trắng. Sau khi hút hơi ẩm từ không khí thì CuSO4 sẽ tạo thành hydrat CuSO4.5H2O.
+ Với CuSO4 ngậm nước: công thức hóa học là CuSO4.nH2O và nó mang màu xanh đặc trưng. Trong đó CuSO4.3H2O (ngậm 3 nước) và CuSO4.5H2O (ngậm 5 nước) là 2 dạng phổ biến nhất hiện nay.
Tính chất vật lý
- Là chất có khả năng dẫn điện tốt.
- CuSO4 khan có cấu trúc tinh thể trực giao trong khi tinh thể CuSO4.5H2O có cấu trúc ba trục.
- Đồng sunfat tan trong nước nhưng ở dạng khan CuSO4 không hòa tan trong etanol và dạng ngậm 5 nước không hòa tan trong etanol nhưng hòa tan trong metanol
Khối lượng riêng:
CuSO4 khan: 3,603 g/cm³
CuSO4 ngậm 5 nước: 2,284 g/cm³
CuSO4 ngậm 7 nước: 1,944 g/cm³
Tính chất hóa học
- Vì nó không làm đổi màu giấy quỳ tím vậy nên CuSO4 là một loại muối trung tính
- Cho muối đồng sunfat tác dụng với dung dịch bazơ sản phẩm tạo ra muối mới và bazo mới. Cụ thể như phương trình sau:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
- Tác dụng được với các kim loại đứng trước đồng (Cu) trong bảng tuần hoàn các nguyên tố hóa học như Mg, Fe, Zn, Al, Sn, Pb… tạo ra muối mới và đồng, như phương trình dưới đây:
CuSO4 + Fe → FeSO4 + Cu
CuSO4 + Zn → ZnSO4 + Cu
CuSO4 + Mg → MgSO4 + Cu
CuSO4 + Sn → SnSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
- Tác dụng với nước chuyển thành dung dịch đồng ngậm nước có màu xanh, cụ thể như sau:
CuSO4+ 5H2O → CuSO4.5H2O (màu xanh)
- Tác dụng với muối tạo ra hỗn hợp 2 muối mới:
BaCl2 + CuSO4 → CuCl2 + BaSO4
- Tác dụng với dung dịch NH3 tạo ra đồng hidroxit và muối amoni sunfat:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
- Phương trình hóa học phản ứng thể hiện nhiệt phân đồng ngậm nước:
CuSO4.5H2O → CuSO4.3H2O → CuSO4.H2O → CuSO4.
Đồng sunfat là điện ly mạnh hay yếu ?
- Khi tan trong nước các phân tử sẽ phân li hoàn toàn và CuSO4 có khả năng dẫn điện nên đồng sunfat là chất điện năng li mạnh:
CuSO4 → Cu2+ + SO42-
Đồng sunfat có kết tủa không ?
- Đồng Sunfat không kết tủa nhưng có thể tạo kết tủa khi được trộn với dung dịch của một muối kiềm như NaOH, KOH, Ba(OH)2, Mg(OH)2 hoặc Ca(OH)2, các ion Cu2+ trong CuSO4 sẽ tạo kết tủa hydroxit đồng (II) (Cu(OH)2 theo phản ứng:
CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4
PTHH thường gặp
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 ↓ + 2(NH4)2SO4
CuSO4 + Ba(NO3)2 → Cu(NO3)2 + BaSO4
CuSO4 + BaCl2 → CuCl2 + BaSO4
CuSO4 + H2S → CuS ↓ + H2SO4
CuSO4 + Na2S → CuS ↓ + Na2SO4
3CuSO4 + 2Al → 3Cu + Al2(SO4)3
CuSO4 + Fe → Cu + FeSO4
Phương pháp điều chế
- Chúng ta có thể tinh chế phế liệu với kim loại nóng chảy, sau đó thực hiện đổ vào nước để tạo ra các mảnh xốp có hình cầu nhỏ. Sau khi hỗn hợp này khi hòa tan trong dung dịch axit sunfuric loãng trong không khí để tạo nên CuSO4.
- Đun nóng quặng đồng sunfua để tạo thành oxit đồng và xử lý bằng axit sunfuric sẽ thu được đồng sunfat.
- Một số phương trình điều chế ra đồng sunfat:
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Cu + H2SO4 đặc nóng Cu + 2H2SO4 → CuSO4 + SO2 ↑ + 2H2O
Dấu hiệu nhận biết
- Với CuSO4 dạng khan bột trắng: khi tan trong nước thì CuSO4 tan chuyển từ màu trắng thành dung dịch có màu xanh.
- Với CuSO4 ngậm 5 nước có dạng tinh thể lam
- CuSO4 ngậm 7 nước có dạng tinh thể xanh dương
Sơ đồ tư duy của đồng sunfat