

Đồng | Cu (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 20/12/2023
20/12/2023
Bài viết tìm hiểu về Đồng (Cu) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Đồng (Cu): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
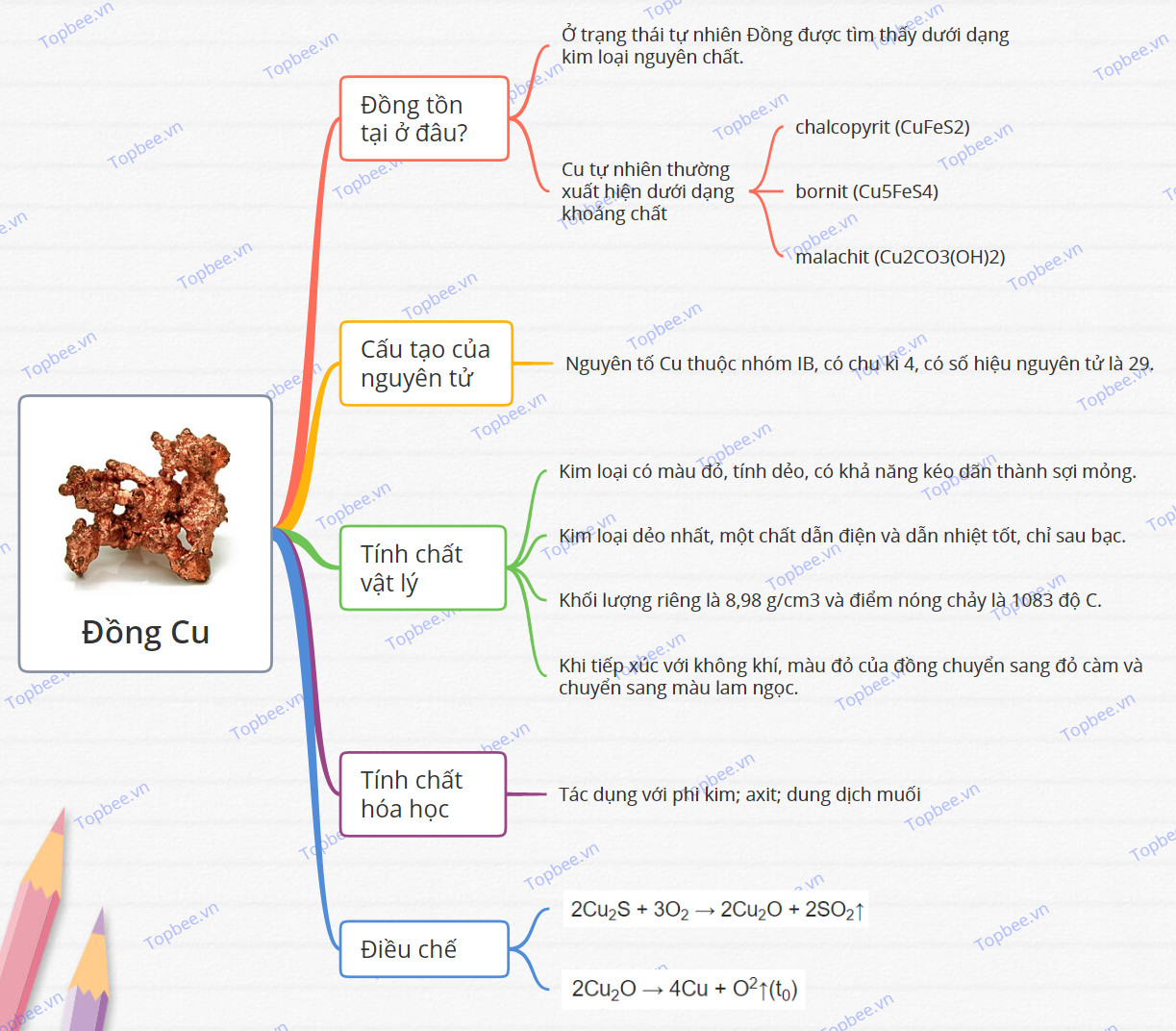
Đồng là gì?
- Đồng là nguyên tố hóa học có kí hiệu Cu. Trong bảng tuần hoàn hóa học Cu là nguyên tố thứ 29.
- Đồng là kim loại có tính dẻo, dẫn dẫn nhiệt và dẫn điện tốt.
- Đồng và hợp kim của đồng được con người phát hiện và đưa vào sử dụng từ cách đây hàng nghìn năm. Trong tự nhiên Đồng chiếm khoảng 69%.
Đồng tồn tại ở đâu?
- Ở trạng thái tự nhiên Đồng được tìm thấy dưới dạng kim loại nguyên chất.
- Đồng là kim loại khá phổ biến có sẵn ở nhiều mỏ khoáng sản khác nhau trên khắp thế giới.
- Cu tự nhiên thường xuất hiện dưới dạng khoáng chất:
+ chalcopyrit (CuFeS2)
+ bornit (Cu5FeS4)
+ malachit (Cu2CO3(OH)2)
- Hoặc Đồng tồn tại dưới dạng nguyên tố Đồng trong các mạch đá, đất và cát.
- Trong trạng thái tự nhiên, Đồng (Cu) có màu đỏ cam đặc trưng và có khả năng dẫn điện và dẫn nhiệt tốt.
Cấu tạo của nguyên tử Đồng
- Nguyên tố Cu thuộc nhóm IB, có chu kì 4, có số hiệu nguyên tử là 29.
- Cấu hình electron nguyên tử của Cu: [Ar] 3d104s1 ; Cu+: [Ar] 3d10; Cu2+:[Ar] 3d9
Tính chất vật lý
- Đồng (Cu) là kim loại có màu đỏ, tính dẻo, có khả năng kéo dãn thành sợi mỏng.
- Đồng là một trong những kim loại dẻo nhất, một chất dẫn điện và dẫn nhiệt tốt, chỉ sau bạc.
- Khối lượng riêng là 8,98 g/cm3 và điểm nóng chảy là 10830C.
- Khả năng điện sẽ giảm dần khi đồng bị tạp chất pha trộn.
- Khi tiếp xúc với không khí, màu đỏ của đồng chuyển sang đỏ càm và chuyển sang màu lam ngọc.

Tính chất hóa học
Đồng là loại kim loại có tính khử yếu hơn so với các kim loại khác. Đồng có thể tác dụng được với phi kim, tác dụng với các axit và tác dụng với các dung dịch muối
a. Tác dụng với phi kim
- Khi (Cu) phản ứng với Oxi đun nóng sẽ tạo thành CuO bảo vệ do đó (Cu) sẽ không bị oxi hoá.
2Cu + O2 → CuO
- Khi ta đun nóng đến nhiệt độ từ (800 - 1000oC)
CuO + Cu → Cu2O (đỏ)
- Khi tác dụng trực tiếp với khí Cl2, Br2, S…
Cu + Cl2 → CuCl2
Cu + S → CuS
b. Tác dụng với các axit
- (Cu) không thể tác dụng với dung dịch HCl và H2SO4 loãng.
- Khi có oxi, (Cu) có thể tác dụng với dung dịch HCl, có tiếp xúc giữa axit và không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
- Đối với HNO3, H2SO4 đặc thì:
Cu + 2H2SO4(đặc) → CuSO4 + SO2 + H2O
Cu + 4HNO3(đặc) → Cu(NO3)2 + 2NO2 + 2H2O
c. Tác dụng với các dung dịch muối
- Đồng có thể khử được các ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Điều chế
- Chalcopyrit (CuFeS2) và chalcocit (Cu2S) là các đồng sulfua. Các khoáng này được tách ra từ quặng nghiền nhằm nâng hàm lượng lên 10 - 15% đồng bằng froth flotation hay bioleaching. Tiến hành nung vật liệu này với silica trong flash smelting để loại sắt ở dạng xỉ.
- Quá trình này chuyển sắt sulfua thành dạng ôxit của nó, các ôxit này phản ứng với silica để tạo ra xỉ silicat nổi lên trên khối nóng chảy tạo ra sản phẩm racopper matte chứa Cu2S. Sau đó từ roasted để chuyển tất cả các sulfua thành ôxit.
2Cu2S + 3O2 → 2Cu2O + 2SO2↑
- Từ Oxit đồng được chuyển thành đồng blister theo phản ứng nung
2Cu2O → 4Cu + O2↑(t0)
Ứng dụng
- Hợp kim của Đồng được ứng dụng nhiều trong công nghiệp và đời sống.
+ Đồng thau (hợp kim của Cu-Zn (45% Zn)): Tính chất cứng và bền, dùng để chế tạo chi tiết máy và các thiết bị dùng trong công nghiệp đóng tàu.
+ Đồng bạch (hợp kim của Cu-Ni (25% Ni)): Tính chất bền, không bị ăn mòn trong nước biển. Dùng trong công nghiệp tàu thủy, đúc tiền…)
+ Đồng thanh (hợp kim của Cu-Sn): Được ứng dụng trong chế tạo máy móc và thiết bị.
+ Vàng 9 cara (hợp kim của Cu-Au (Au chiếm 2/3)): Ứng dụng đúc đồng tiền vàng và các vật trang trí.
Một số hợp chất
* Đồng (II) oxit
- CuO: là chất rắn màu đen, không tan trong nước
- Là oxit bazơ; dễ bị CO, C, H2 khử thành Cu kim loại
* Đồng (II) hidroxit
- Cu(OH)2: là chất rắn màu xanh
- Có tính bazơ, không tan trong nước nhưng tan dễ trong dung dịch axit
* Đồng sunfat
- CuSO4 dạng khan là chất rắn màu trắng, trạng muối hiđrat CuSO4.5H2O có màu xanh.
- Trên 50% sản lượng dùng làm dây dẫn điện và trên 30% dùng làm hợp kim; hợp kim của đồng như đồng thau (Cu – Zn) ; đồng bạch (Cu–Ni) ; đồng thanh (Cu – Sn) ;… có rất nhiều ứng dụng trong công nghiệp và đời sống như: chế tạo chi tiết máy, thiết bị dùng trong công nghiệp đóng tàu biển
+ CuSO4 dùng trong nông nghiệp để chữa mốc sương cho cà chua, khoai tây; ở dạng khan thì dùng để phát hiện vết nước trong các chất lỏng
Sơ đồ tư duy
Một số câu hỏi
Câu 1: Trong tự nhiên, đồng có hai đồng vị bền. Nguyên tử khối trung bình của đồng là 63,54. Tính số mol mỗi loại đồng vị có trong 6,354 gam đồng.
Câu 2: Cho 24 gam hỗn hợp CuO và Fe2O3 hòa tan vừa đủ vào 146 gam dung dịch HCl 20%. Tính khối lượng oxit có trong hỗn hợp ban đầu
Câu 3: Cho Cu (z = 29), vị trí của Cu trong bảng tuần hoàn là
A. ô 29, chu kỳ 4, nhóm IB.
B. ô 29, chu kỳ 4, nhóm IA.
C. ô 29, chu kỳ 4, nhóm VIIIB.
D. ô 29, chu kỳ 4, nhóm IIB.
Câu 4: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì
A. Phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh.
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. Phản ứng tạo ra kết tủa màu xanh.
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Câu 5: Cho 4g NaOH tác dụng với CuSO4 tạo ra Cu(OH)2 kết tủa và Na2SO4. Hãy
a/ Viết PTHH
b/ Tính khối lượng CuSO4 đã phản ứng
c/ Tính khối lượng các chất sản phẩm thu được





