Fe(OH)3 (kết tủa không, điện ly mạnh hay yếu, mindmap)
 15/1/2024
15/1/2024
Tổng hợp kiến thức về Fe(OH)3: Cấu tạo phân tử, Tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp học sinh ôn tập, bổ sung kiến thức
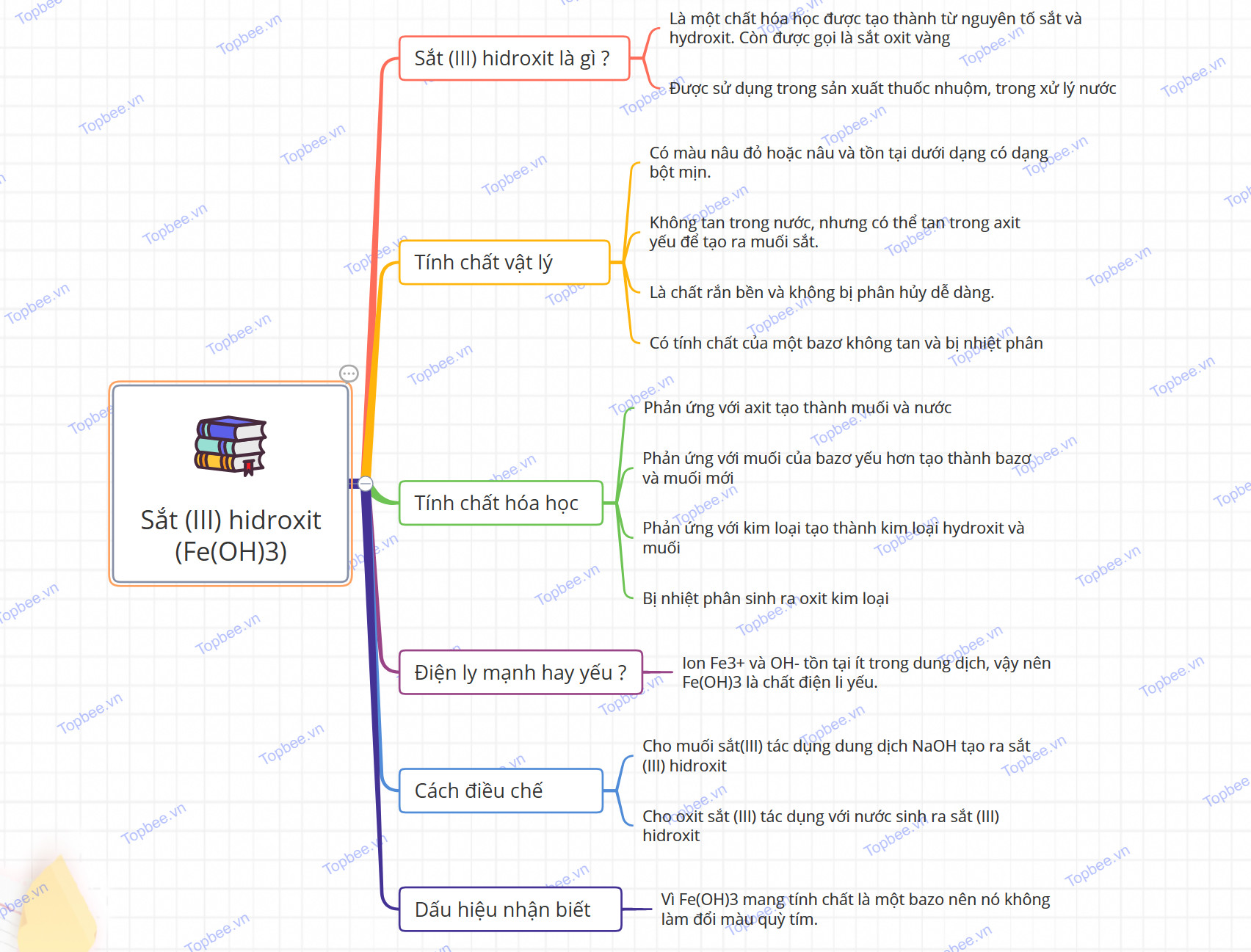
Sắt (III) hidroxit (Fe(OH)3) là gì ?
- Khái niệm: Sắt (III) hidroxit là một chất hóa học được tạo thành từ nguyên tố sắt và hydroxit. Công thức hóa học được ký hiệu là Fe(OH)3 và còn được gọi là sắt oxit vàng.
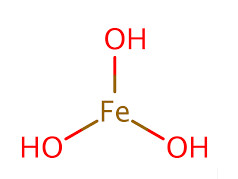
- Cấu tạo phân tử:
- Hiện nay sắt (III) hidroxit được sử dụng trong sản xuất thuốc nhuộm, trong xử lý nước và trong sản xuất các sản phẩm vật liệu xây dựng.
Tính chất vật lý
- Sắt (III) hidroxit có màu nâu đỏ hoặc nâu, tồn tại dưới dạng có dạng bột mịn và có độ pH trung tính.
- Fe(OH)3 có tính chất của một bazơ không tan và bị nhiệt phân
- Khối lượng riêng của Fe(OH)3 là khoảng 3,4 g/cm3.
- Fe(OH)3 không tan trong nước, nhưng có thể tan trong axit yếu để tạo ra muối sắt.
- Fe(OH)3 là chất rắn bền và không bị phân hủy dễ dàng.
Tính chất hóa học
- Phản ứng với axit tạo thành muối và nước. Cụ thể như phương trình tổng quát sau:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
- Phản ứng với muối của bazơ yếu hơn tạo thành bazơ và muối mới. Cụ thể như phương trình tổng quát sau:
Fe(OH)3 + 3NaOH → 3NaOH + Fe(OH)3
- Phản ứng với kim loại tạo thành kim loại hydroxit và muối. Cụ thể như phương trình tổng quát sau:
Fe(OH)3 + 3Zn → 3Zn(OH)2 + FeSO4
- Vì sắt hidroxit là một bazơ không tan nên trong môi trường nhiệt độ trên 200oC bị nhiệt phân sinh ra oxit kim loại, phản ứng xảy ra theo phương trình sau:
2Fe(OH)3 → Fe2O3 + 3H2O
Sắt (III) hidroxit (Fe(OH)3) là chất điện ly mạnh hay yếu ?
- Fe(OH)3 phân li thành Fe3+ và OH- ion. Fe3+ là ion có khả năng kết hợp với các ion OH- tạo thành phức chất không tan trong nước, là nguyên nhân gây ra hiện tượng kết tủa trong dung dịch của Fe OH3.
→ Ion Fe3+ và OH- tồn tại ít trong dung dịch, vậy nên Fe(OH)3 là chất điện li yếu.
Sắt (III) hidroxit (Fe(OH)3) có kết tủa không ?
- Kết tủa khi có các ion sắt (III) và ion hidroxit trong dung dịch. Khi muối sắt (III) được pha loãng trong nước, các ion sắt (III) sẽ tương tác với các ion hidroxit để tạo thành kết tủa Fe(OH)3 , cụ thể như phương trình dưới đây:
Fe3+ + OH- → Fe(OH)3
PTHH thường gặp
2Fe(OH)3 → Fe2O3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3+ 3H2O
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HI → FeI3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Phương pháp điều chế
- Cho muối sắt(III) tác dụng dung dịch NaOH tạo ra sắt (III) hidroxit:
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Các bước thực hiện để điều chế Fe(OH)3 bằng phương pháp cho tác dụng với bazo:
B1: Lấy một lượng muối sắt (III) cần dùng.
B2: Hòa tan muối sắt (III) trong nước để thu được dung dịch muối sắt (III).
B3: Cho dung dịch muối sắt (III) vào dung dịch bazơ, chẳng hạn như dung dịch NaOH.
B4: Khuấy đều cho đến khi phản ứng xảy ra hoàn toàn.
B5: Lọc lấy kết tủa Fe(OH)3.
B6: Rửa sạch kết tủa Fe(OH)3 bằng nước cất.
B7: Sấy khô kết tủa Fe(OH)3 ở nhiệt độ thấp.
- Cho oxit sắt (III) tác dụng với nước sinh ra sắt (III) hidroxit. Cụ thể như theo phương trình phản ứng sau:
Fe2O3 + 3H2O → 2Fe(OH)3
Các bước thực hiện để điều chế Fe(OH)3 bằng phương pháp cho tác dụng với nước:
B1: Lấy một lượng oxit sắt (III) cần dùng.
B2: Cho oxit sắt (III) vào nước.
B3: Khuấy đều cho đến khi phản ứng xảy ra hoàn toàn.
B4: Lọc lấy kết tủa Fe(OH)3.
B5: Rửa sạch kết tủa Fe(OH)3 bằng nước cất.
B6: Sấy khô kết tủa Fe(OH)3 ở nhiệt độ thấp.
Dấu hiệu nhận biết
- Vì Fe(OH)3 mang tính chất là một bazo nên nó không làm đổi màu quỳ tím.
Sơ đồ tư duy của Sắt (III) hidroxit (Fe(OH)3)