

Iot I (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Iot (I) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Iot (I): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
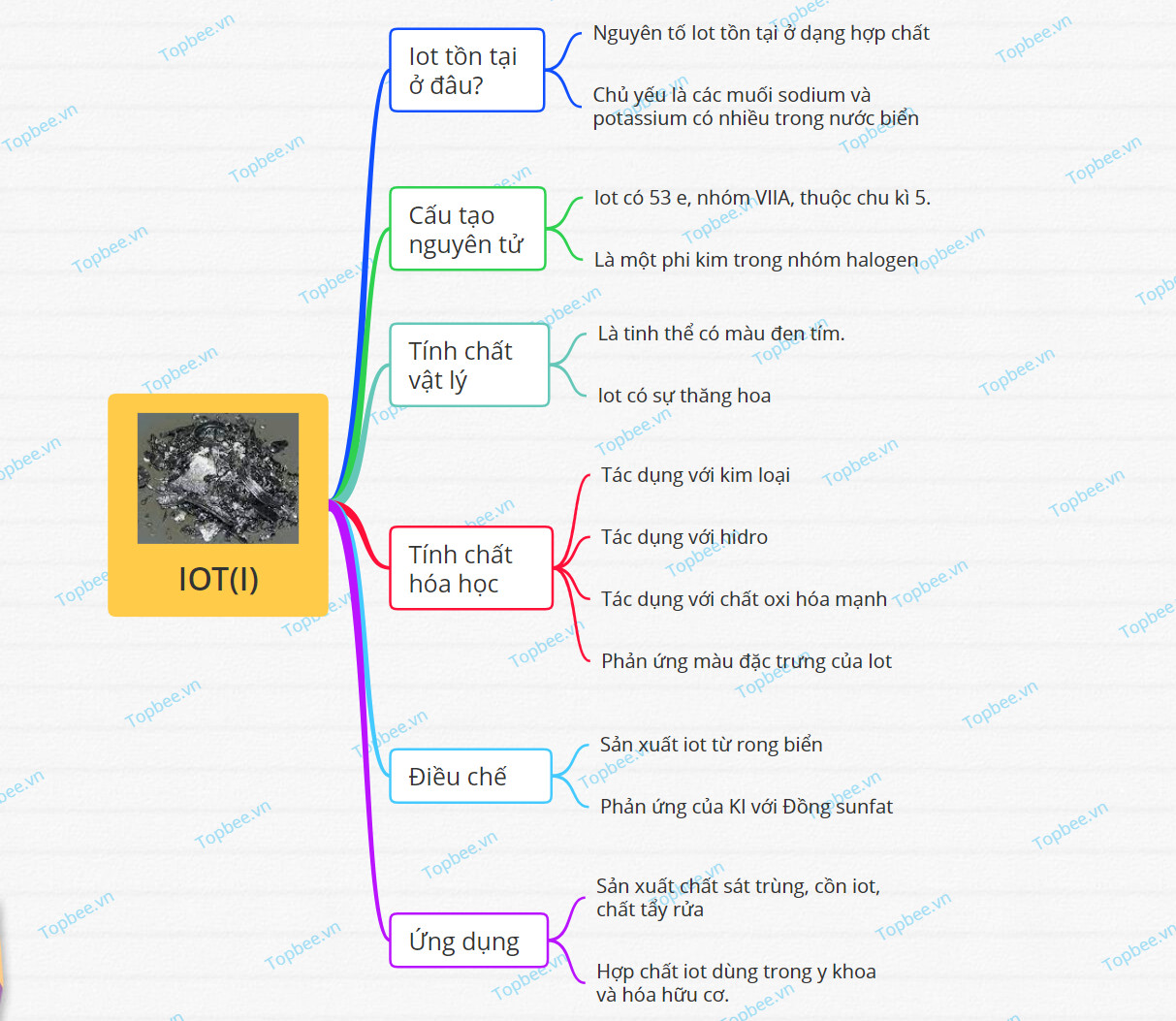
Iot tồn tại ở đâu?
- Iot là nguyên tố hóa học kí hiệu là I và có số hiệu nguyên tử là 53 trong bảng tuần hoàn các nguyên tố hóa học.
- Trong tự nhiên, nguyên tố Iot tồn tại ở dạng hợp chất:
+ Chủ yếu là các muối sodium và potassium có nhiều trong nước biển.
+ Hợp chất của Iot còn gặp trong một số loài rong biển.
Cấu tạo nguyên tử
- Cấu hình electron: 1s22s22p63s23p63d104s24p64d105s25p5
Viết gọn: [Kr]4d105s25p5
- Nguyên tố Iot có 53 electron, nhóm VIIA, thuộc chu kì 5.
- Iot là một phi kim trong nhóm các nguyên tố halogen
- Có 37 đồng vị , bền nhất là 127I.
Tính chất vật lý
- Iot là chất rắn, dạng tinh thể, có màu đen tím.

- Tan ít trong nước nhưng tan nhiều trong dung môi hữu cơ: etanol, ete,…
- Nguyên tử khối: 127 g/mol.
- Sự thăng hoa của Iot:
+ Khi đun nóng, iot chuyển thành thể hơi.
+ Khi làm lạnh, hơi iot chuyển thành tinh thể, không thông qua thể lỏng
Tính chất hóa học
- Iot cũng là chất oxi hoá mạnh, nhưng kém clo và brom
*Tác dụng với kim loại
- Iot phản ứng trực tiếp với nhiều kim loại, có trường hợp cần đun nóng, có trường hợp xảy ra ở ngay nhiệt độ thường, các phản ứng đều
toả ra nhiều nhiệt
2Al + 3I2 → 2AlI3
*Tác dụng với hidro
- Ở nhiệt độ cao iot mới phản ứng với hidro:
H2 + I2 → 2HI
- Hidro iotua không bền, ngay ở những điều kiện tạo thành một phần bị phân huỷ thành hidro và Iot :
2HI → H2 + I2
- Do vậy, phản ứng giữa hidro và Iot không thực hiện đến cùng.
* Lưu ý:
- Hidro iotua tan trong nước tạo thành axit tương ứng có cùng công thức: hidroiodic axit HI là axit mạnh.
HF < HCl < HBr < HI
- Không dùng dung dịch H2SO4 đặc và muối iot để điều chế HI:
8HI + H2SO4(đ) → 4I2 + H2S + 4H2O
*Phản ứng màu đặc trưng của Iot
- Iot tạo thành hợp chất có màu xanh với tinh bột. Do vậy, iot I2 là thuốc thử tinh bột và ngược lại.
*Halogen mạnh đẩy halogen yếu ra khỏi muối
- Clo, brom đẩy được Iot ra khỏi dung dịch NaI.
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
→ Điều đó chứng tỏ rằng clo, brom hoạt động hoá học hơn Iot .
*Tác dụng với chất oxi hóa mạnh
Iot còn thể hiện tính khử khi tác dụng với chất ôxi hóa mạnh
I2 + 5Cl2 + 6H2O → 2HIO3 + 10HCl
Điều chế
*Trong công nghiệp:
- Sản xuất iot từ rong biển, với số lượng lớn, giá thành rẻ.
Người ta cho dung dịch phản ứng với chất oxi hoá để oxi hoá I- thành I2:
2NaI + Cl2 -> 2NaCl + I2
- Ngoài ra, có thể thu Iot tinh khiết bằng phản ứng của KI với sunfat đồng (II) hay tách iot từ tảo bẹ,..
Ứng dụng
- Ứng dụng trong sản xuất chất sát trùng cồn iot 5%, chất tẩy rửa, ...
- Hợp chất iot thường được sử dụng trong y khoa và hóa hữu cơ.
- Iot kết hợp với lượng nhỏ KI và KIO3 thành muối iot giúp phòng tránh các rối loạn do thiếu iot như bướu cổ.
- Muối iodide bạc (AgI) được dùng trong ngành nhiếp ảnh.
- Iốt được trong quá trình xử lý nước cấp và nước thải để loại bỏ các chất ô nhiễm
Một số hợp chất
*Khí hiđro iotua, axit iothiđric: HI
+ Là một axit mạnh, bị điện li hoàn toàn.
+ Dung dịch HI là một dung dịch không màu
+ Axit HI bị oxi hoá dần bởi oxi trong không khí, sinh ra iot.
+ HI nguồn iốt chính dùng để tổng hợp các chất vô cơ và hữu cơ.
*Muối Kali iotua: KI
+ Là chất rắn màu trắng, cấu trúc tinh thể giống muối ăn NaCl.
+ Kali iotua là hợp chất được sử dụng trong thuốc men và thực phẩm chức năng.
+ KI dùng để điều trị cường giáp, bảo vệ tuyến giáp khi tiếp xúc với một số dược phẩm phóng xạ.
Sơ đồ tư duy
Một số câu hỏi
Câu 1: Muối NaCl có lẫn tạp chất là NaI.
a) Làm thế nào để chứng minh rằng trong muối NaCl nói trên có lẫn tạp chất NaI?.
b) Làm thế nào để có NaCl tinh khiết.
Câu 2: Dẫn từ từ clo vào dung dịch NaI có chứa sẵn một ít hồ tinh bột. Hiện tượng xảy ra là
A. Không hiện tượng.
C. Dung dịch chuyển sang màu xanh.
B. Dung dịch hóa đỏ.
D. Dung dịch xuất hiện kết tủa.
Câu 3: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. sự thăng hoa.
B. sự bay hơi.
C. sự phân hủy.
D. sự ngưng tụ.
Câu 4: Theo tính toán của các nhà khoa học, mỗi ngày cơ thể người cần được cung cấp 1,5.10–4g nguyên tố Iot. Nếu nguồn cung cấp chỉ
là KI thì khối lượng KI cần dùng cho một người trong một ngày là bao nhiêu ?





