

Kẽm | Zn (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 20/12/2023
20/12/2023
Bài viết tìm hiểu về Kẽm (Zn) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Kẽm (Zn): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
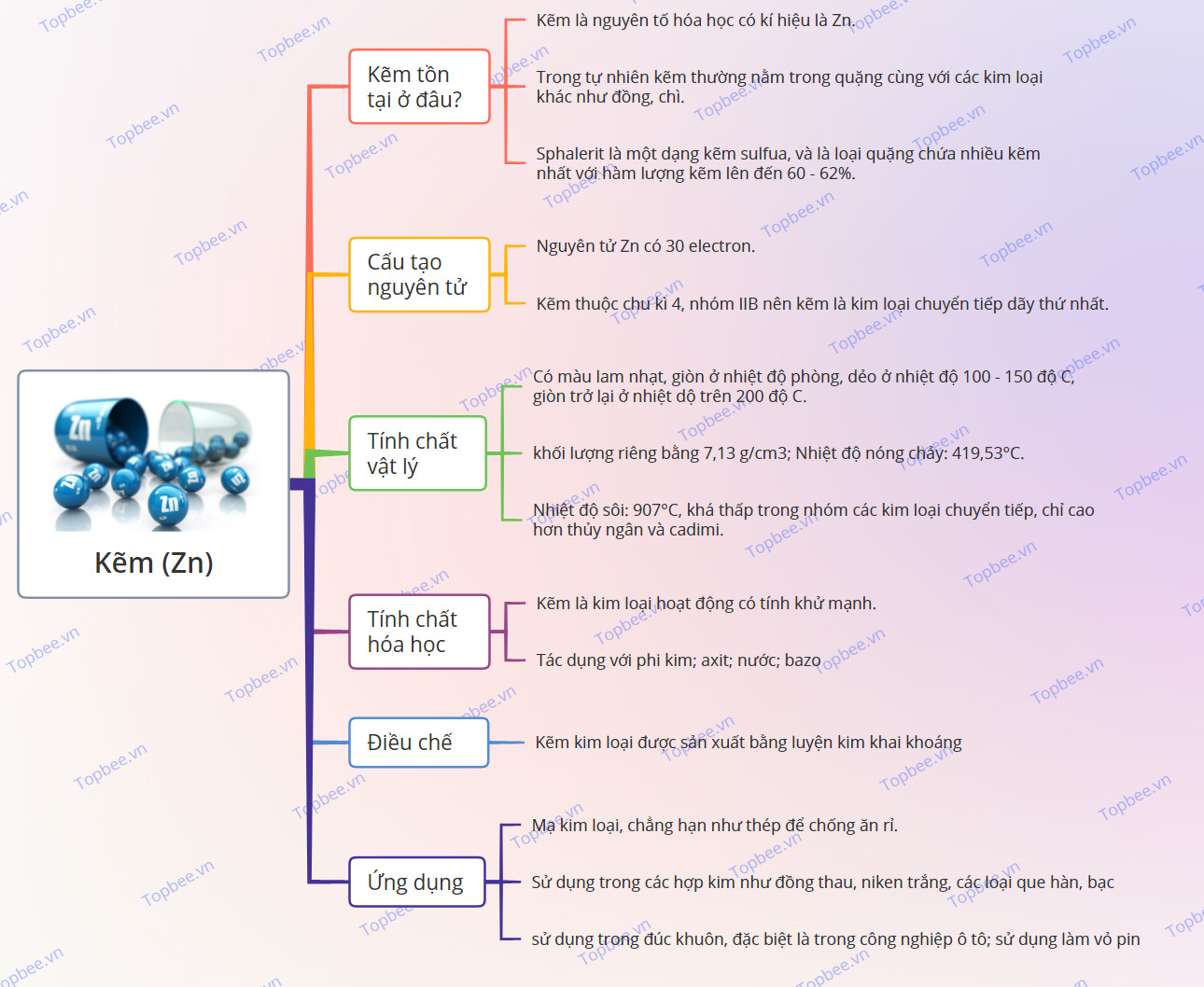
Kẽm tồn tại ở đâu?
- Kẽm là nguyên tố hóa học có kí hiệu là Zn.
- Trong tự nhiên kẽm thường nằm trong quặng cùng với các kim loại khác như đồng, chì.
- Sphalerit là một dạng kẽm sulfua, và là loại quặng chứa nhiều kẽm nhất với hàm lượng kẽm lên đến 60 - 62%.
- Các loại khoáng khác có thể thu được kẽm như smithsonit (kẽm cacbonat), hemimorphit (kẽm silicat), wurtzit (loại kẽm sulfua khác), và đôi khi là hydrozincit (kẽm cacbonat)
Cấu tạo nguyên tử của Kẽm
- Nguyên tử Zn có 30 electron.
- Cấu hình electron nguyên tử kẽm là 1s22s22p63s23p63d104s2. Viết gọn: [Ar] 3d104s2.
- Kẽm thuộc chu kì 4, nhóm IIB nên kẽm là kim loại chuyển tiếp dãy thứ nhất.
- Trong các phản ứng hóa học, kẽm có xu hướng nhường 2 electron.
Zn ⟶ Zn2+ + 2e
Tính chất vật lý
- Kẽm là kim loại có màu lam nhạt, giòn ở nhiệt độ phòng, dẻo ở nhiệt độ 100 - 1500C, giòn trở lại ở nhiệt dộ trên 2000C.
- Kẽm có khối lượng riêng bằng 7,13 g/cm3,
- Nhiệt độ nóng chảy: 419,53°C.
- Nhiệt độ sôi: 907°C, khá thấp trong nhóm các kim loại chuyển tiếp, chỉ cao hơn thủy ngân và cadimi.

Tính chất hóa học
- Kẽm là kim loại hoạt động có tính khử mạnh.
a. Tác dụng với phi kim
- Zn tác dụng trực tiếp với nhiều phi kim.
Ví dụ:
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
- Ở điều kiện thường, Zn bị oxi hóa trong không khí hình thành lớp oxit bền bảo vệ ngăn không cho phản ứng tiếp tục xảy ra.
b. Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4loãng:
Ví dụ:
Zn + 2HCl → ZnCl2 + H2
Phương trình ion:
Zn + 2H+ → Zn2+ + H2
(Zn khử ion H+ trong dung dịch axit thành hidro tự do).
- Với dung dịch HNO3, H2SO4 đặc:
Với các axit HNO3 đặc nóng, HNO3 loãng, H2SO4 đặc: Zn khử được N+5 và S+6 xuống những mức oxi hoá thấp hơn.
Zn + 4HNO3đ → Zn(NO3)2 + 2NO2 + 2H2
c. Tác dụng với H2O
- Do Eo Zn2+ /Zn < Eo H2O/H2 (Zn khử được nước)
- Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
d. Tác dụng với bazơ
- Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Ví dụ: Cho Zn vào dung dịch NaOH
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Điều chế
- Kẽm kim loại được sản xuất bằng luyện kim khai khoáng. Sau khi nghiền quặng, phương pháp tuyển nổi bọt được sử dụng để tách các khoáng dựa vào tính dính ướt khác nhau của chúng. Ở bước cuối cùng này thì kẽm chiếm 50%, phần còn lại là lưu huỳnh (32%), sắt (13%), và SiO2 (5%).
- Công đoạn thiêu kết sẽ chuyển kẽm sulfua thành kẽm oxit
2ZnS + 3O2 → 2ZnO + 2SO2
- Sau đó, người ta có thể dùng 2 phương pháp cơ bản trong luyện kim là nhiệt luyện (pyrometallurgy) hoặc điện phân (electrowinning). Quá trình nhiệt luyện khử kẽm ôxít với cacbon hoặc cacbon mônôxít ở 950 °C (1.740 °F) thành kim loại kẽm ở dạng hơi. Hơi kẽm được thu hồi trong bình ngưng. Quá trình được biểu diễn theo các phương trình dưới đây:
2ZnO + C → 2Zn + CO2
2ZnO + 2CO → 2Zn + 2CO2
- Quá trình điện phân, tách kẽm từ quặng tinh bằng axit sulfuric.
ZnO + H2SO4 → ZnSO4 + H2O
Sau đó, người ta dùng phương pháp điện phân để sản xuất kẽm kim loại
2ZnSO4 + 2H2O → 2Zn + 2H2SO4 + O2
Ứng dụng
- Kẽm là kim loại được sử dụng phổ biến hàng thứ tư sau sắt, nhôm, đồng tính theo lượng sản xuất hàng năm:
- Kẽm được sử dụng để mạ kim loại, chẳng hạn như thép để chống ăn rỉ.
- Kẽm được sử dụng trong các hợp kim như đồng thau, niken trắng, các loại que hàn, bạc Đức v.v. Đồng thau có ứng dụng rộng rãi nhờ độ cứng và sức kháng rỉ cao.
- Kẽm được sử dụng trong đúc khuôn, đặc biệt là trong công nghiệp ô tô
- Kẽm dạng cuộn được sử dụng để làm vỏ pin
Một số hợp chất
- Kẽm clorua: ZnCl2
+ Kẽm Clorua (Zinc chloride) tồn tại ở chất rắn màu trắng, không mùi, hút ẩm mạnh và tan nhiều trong nước.
+ Sử dụng phổ biến trong mạ kẽm lên sắt, được bôi vào khuôn đúc, đánh bóng thép, đôi khi được sử dụng làm hóa chất tẩy rửa, làm sạch bề mặt kim loại.
+ Ứng dụng rộng rãi trong ngành công nghiệp sản xuất giấy, dệt may và bảo quản gỗ trước những tác động từ môi trường.
- Kẽm oxit: ZnO
+ Chất rắn màu trắng, bền với nhiệt, không tan trong nước. khi nung trên 300oC, nó chuyển sang màu vàng (sau khi làm lạnh thì trở lại màu trắng)
+ ZnO dùng để chữa viêm da, eczecma,....
+ ZnO là một thành phần quan trọng trong các loại kem, thuốc mỡ điều trị về da
- Kẽm hiđroxit: Zn(OH)2
+ Không tan trong nước, kết tủa dạng keo trắng.
+ Kẽm hiđrôxít được sử dụng để hút máu trong các băng y tế lớn. Những băng này được sử dụng sau khi phẫu thuật.
Sơ đồ tư duy
Một số câu hỏi
Câu 1: Cho m gam hỗn hợp hai kim loại Fe, Zn tác dụng hết với 200 ml dung dịch HCl 1,6M thoát ra 3,36 lít (đktc) khí H2. Dung dịch thu được có giá trị pH là (bỏ qua các quá trình thuỷ phân của muối)
A. 2.
B. 7.
C. 4.
D. 1.
Câu 2: X là một hợp chất của Zn thường được dùng trong y học, với tác dụng làm thuốc giảm đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,.... Chất X là
A. Zn(NO3)2.
B. ZnSO4.
C. ZnO.
D. Zn(OH)2.
Câu 3: Để bảo vệ vỏ tàu biển bằng thép bằng phương pháp điện hóa người ta dùng kim loại nào sau đây?
A. Cu.
B. Pb.
C. Zn.
D. Sn.
Câu 4: Nêu phương pháp điều chế kẽm. Viết các PTHH của các phản ứng xảy ra.





