KMnO4 (kết tủa không, điện ly mạnh hay yếu, mindmap)
 15/1/2024
15/1/2024
Tổng hợp kiến thức về KMnO4: Cấu tạo phân tử, Tính chất vật lí, hóa học, phương pháp điều chế, ứng dụng, Mindmap giúp học sinh ôn tập, bổ sung kiến thức
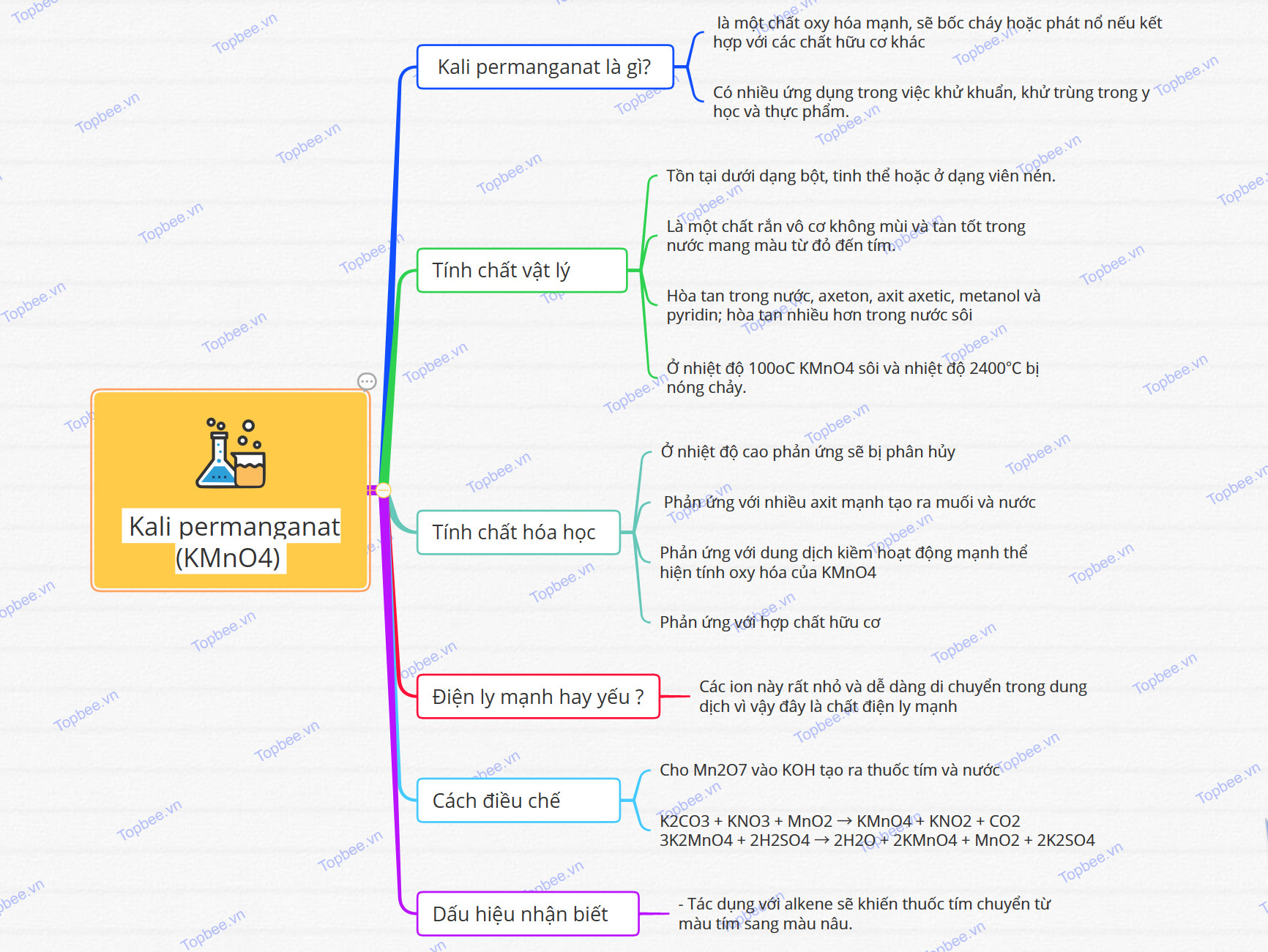
Khái quát về Kali permanganat (KMnO4)
- Khái niệm: KMnO4 là một chất oxy hóa mạnh, sẽ bốc cháy hoặc phát nổ nếu kết hợp với các chất hữu cơ khác. Đồng thời là một chất rắn vô cơ không mùi và tan tốt trong nước tạo ra dung dịch mang màu tím đặc trưng.
Được nhiều người biết đến với tên gọi là thuốc tím.
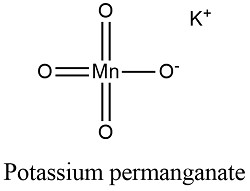
- Cấu tạo phân tử:
- Có nhiều ứng dụng trong việc khử khuẩn, khử trùng trong y học và thực phẩm.
Tính chất vật lý
- Tồn tại dưới dạng bột, tinh thể hoặc ở dạng viên nén.
- KMnO4 là một chất rắn vô cơ không mùi và tan tốt trong nước mang màu từ đỏ đến tím.
- Hòa tan trong nước, axeton, axit axetic, metanol và pyridin; hòa tan nhiều hơn trong nước sôi và tan nhanh hơn trong etanol và dung môi hữu.
- Khối lượng riêng là 2,7g/ml và khối lượng mol là 158,034g / mol.
- Ở nhiệt độ 100oC KMnO4 sôi và nhiệt độ 2400℃ bị nóng chảy.
Tính chất hóa học
- Ở nhiệt độ cao phản ứng sẽ bị phân hủy:
2KMnO4 → K2MnO4 + MnO2 + O2
- KMnO4 phản ứng với nhiều axit mạnh tạo ra muối và nước, cụ thể như phương trình phản ứng sau:
2KMnO4+ H2SO4 → Mn2O7 + K2SO₄ + H2O
- Phản ứng với dung dịch kiềm hoạt động mạnh thể hiện tính oxy hóa của KMnO4, cụ thể như ví dụ minh họa dưới đây:
4KMnO4 + 4NaOH + → 2K2MnO4 + 2Na2MnO4 + 2H2O + O2
- Phản ứng với etanol:
4KMnO4 + 3C2H5OH → 3CH3COOH + 4MnO2 + 4KOH + H2O
- Phản ứng với hợp chất hữu cơ như với axetilen trong môi trường kiềm:
C2H2 + 10KMnO4 + 14KOH → 10K2MnO4 + 2K2CO3 + 8H2O
Kali permanganat (KMnO4) là chất điện ly mạnh hay yếu ?
- KMnO4 phân ly thành các ion MnO4- và K+ khi hòa tan trong nước. Các ion này rất nhỏ và dễ dàng di chuyển trong dung dịch vì vậy đây là chất điện ly mạnh
PTHH thường gặp
3K2MnO4 + 4HNO3 → 2KMnO4 + MnO2 + 4KNO3 + 2H2O
4KMnO4 + 4KOH → 4K2MnO4 + 2H2O + O2
2KMnO4+ 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4+ 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
C2H2 + 2KMnO4 + 3H2SO4 → 2CO2 + 2MnSO4 + K2SO4 + 4H20
12KMnO4 + C2H4 + 16KOH → 12K2MnO4 + 2K2CO3 + 10H2O
Ứng dụng của KMnO4
- Hiện nay nó được sử dụng chủ yếu trong việc khử trùng môi trường nước để hạn chế gây ô nhiễm môi trường, tẩy trắng và trong thành phần thuốc trừ sâu.
- Ngoài ra còn dùng để tẩy màu vải dệt, làm bay màu các tinh bột hoặc chất béo.
- Trong y học dùng để rửa dạ dày, hủy chất độc, trị liệu ngộ độc chloral hydrate, alcaloid, barbituric.
Phương pháp điều chế
- Điều chế bằng cách cho Mn2O7 vào KOH tạo ra thuốc tím và nước:
2KOH + Mn2O7 → 2KMnO4 + H2O
- Cho dung dịch KOH và oxit mangan dạng bột, với các chất oxy hóa như kali clorat. Hỗn hợp được đun sôi cho bay hơi và phần cặn được đun nóng trong chảo sắt cho đến khi có được độ nhão.
6KOH + 3MnO2 + 6KClO3 → 3K2MnO4 + 6KCl + 3H2O
Sau đó cho Kali manganate màu xanh lá cây được tạo thành được đun sôi với một lượng lớn nước và dòng điện của clo, CO2 và không khí bị ozon hóa được truyền vào chất lỏng cho đến khi chuyển hóa thành pemanganat. MnO2 được tạo thành được loại bỏ liên tục để ngăn nó phá vỡ pemanganat.
6K2MnO4 + 3Cl2 → 6KMnO4 + 6KCl
- Ngoài ra còn một số phương pháp điều chế trong phòng thí nghiệm như:
K2CO3 + KNO3 + MnO2 → KMnO4 + KNO2 + CO2
3K2MnO4 + 2H2SO4 → 2H2O + 2KMnO4 + MnO2 + 2K2SO4
3K2MnO4 + 2H2O → 2KMnO4 + 4KOH + MnO2
Dấu hiệu nhận biết
- Tác dụng với alkene sẽ khiến thuốc tím chuyển từ màu tím sang màu nâu.
Sơ đồ tư duy của Kali permanganat (KMnO4)