

Nitrogen | N2 (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Nitrogen (N2) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Nitrogen (N2): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
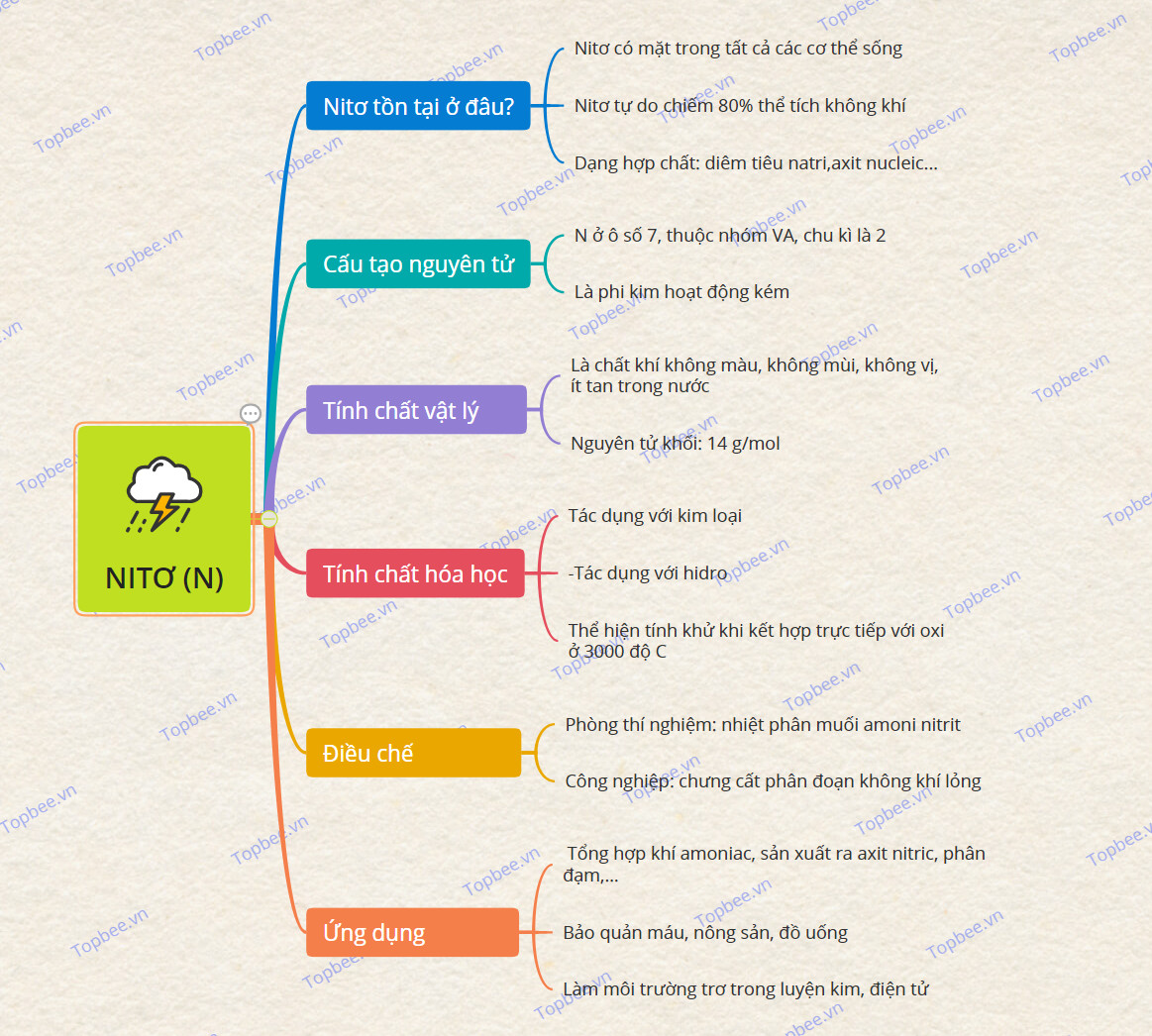
1. Nitrogen tồn tại ở đâu?
- Nitơ là nguyên tố hóa học kí hiệu là N và có số hiệu nguyên tử là 7 trong bảng tuần hoàn học.
- Nitơ có mặt trong tất cả các cơ thể sống, cấu tạo nhiều hợp chất quan trọng như: axit amin, amoniac, axit nitric
- Trong tự nhiên, Nitơ tồn tại dưới 2 dạng:
+ Nitơ tự do chiếm 80% thể tích không khí.
+ Nitơ dạng hợp chất có nhiều ở NaNO3 (diêm tiêu natri),protein, axit nucleic...
2. Cấu tạo nguyên tử Nitrogen
- Cấu tạo phân tử: N2 (N ≡ N), liên kết giữa chúng là liên kết ba.
- Cấu hình electron của Nitơ: 1s22s22p3. Viết gọn: [He]2s22p3.
- Nguyên tố N có 7 electron, ở ô số 7, thuộc nhóm VA, chu kì là 2.
- Mức oxi hoá cao nhất là +5. Ngoài ra, N còn có thêm các mức oxi hoá +1, +2 và +4
+ Nitơ có xu hướng nhận 3 electron khi tham gia phản ứng hóa học để đạt cấu hình bền vững của Ne.
3. Tính chất vật lý của Nitrogen
+ Là chất khí không màu, không mùi, không vị, ít tan trong nước
+ Nguyên tử khối: 14 g/mol, nhẹ hơn không khí.
+ Nitơ chiếm 4/5 trong không khí nhưng không có khả năng duy trì sự cháy và sự sống.
+ Nitơ là phi kim hoạt động kém.
+ Nhiệt độ hoá lỏng: -196 độ C
+ Nhiệt độ hoá rắn: -210 độ C
4. Tính chất hóa học của Nitrogen
+ Khi tham gia phản ứng oxi hóa - khử, nitơ có thể giảm hoặc tăng số oxi hóa nên nitơ vừa có tính oxi hóa, vừa có tính khử.
+ Tính oxi hóa là tính chất chủ yếu của N2.
*Nitơ có tính oxi hóa
+ Nitơ sẽ tác dụng với hầu hết kim loại ở nhiệt độ cao với xúc tác là khí hidro, nhiệt độ, áp suất.
+ Tính oxi hóa khi giảm số oxi hóa từ 0 xuống -3.
+ Ngoại trừ trường hợp tác dụng với Li ở điều kiện thường.
- Tác dụng với kim loại
+ Ở nhiệt độ cao, nitơ thể hiện tính oxi hóa khi tác dụng với một số kim loại hoạt động mạnh như Ca, Mg, Al… và tạo thành nitrua kim
loại.
3Mg + N2 → Mg3N2 (nhiệt độ)
- Tác dụng với hidro
+ Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác, nitơ có thể tác dụng trực tiếp với hidro tạo ra amoniac theo phương trình:
N2 + 3H2 → 2NH3 (nhiệt độ, P, chất xúc tác)
+ Nitơ thể hiện tính oxi hóa khi số oxi hóa giảm từ 0 xuống -3.
*Nitơ có tính khử
+ Ở nhiệt độ khoảng 3000 độ C (hoặc tiếp xúc với tia lửa điện), nitơ sẽ thể hiện tính khử khi kết hợp trực tiếp với oxi và tạo ra khí nitơ
monooxit NO theo phương trình:
N2 + O2 → 2NO (t0)
+ Nitơ thể hiện tính khử khi số oxi hóa tăng từ 0 đến +2.
+ Chất này sẽ bị hóa nâu đỏ trong không khí tạo thành NO2.
5. Điều chế của Nitrogen
* Trong phòng thí nghiệm:
- Điều chế N2 bằng lượng nhỏ amoni clorua và natri nitrit:
+ Tiến hành đun nóng hỗn hợp amoni clorua và natri nitrit
NH4Cl + Na2NO → NaCl + 2H2O + N2
+ Sau đó cho khí sinh ra đi qua dung dịch axit sunfuric trong nước có chứa kali dicromat.
- Đun nóng amoni dicromat:
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
- Phân hủy nhiệt natri azide hoặc bari azide:
2NaN3 → 2Na + 3N2
Ba (N3)2 → Ba + 3N2
* Trong công nghiệp: áp dụng một số phương pháp đơn giản, giá thành rẻ:
+ Phương pháp cơ học: lọc màng, sử dụng áp suất
+ Phương pháp chưng cất đoạn không khí thành dạng lỏng: thu nitơ ở -196 ºC, vận chuyển trong các bình thép, nén dưới áp suất 150 atm.
6. Ứng dụng của Nitrogen
- Nitơ được sử dụng rộng rãi, chủ yếu do tính chất không phản ứng khi tiếp xúc với các loại khí khác.
+ Lớp phủ nitơ được sử dụng để bảo vệ các chất rắn và chất lỏng dễ cháy hoặc nổ khi tiếp xúc với không khí.
+ Trong công nghiệp, phần lớn lượng nitơ để tổng hợp khí amoniac, sản xuất ra axit nitric, phân đạm,…
+ Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử,… sử dụng nitơ làm môi trường trơ.
+ Nitơ lỏng dùng để bảo quản máu và các mẫu vật sinh học khác. Nitơ lỏng được sử dụng trong phẫu thuật lạnh để phá hủy mô
bệnh.
+ Sử dụng nitơ để thay thế khí oxi trong việc bảo quản nông sản, đồ uống tốt hơn
+ Dùng nitơ để thanh lọc thiết bị, bể chứa và đường ống chứa hơi và khí nguy hiểm trong ngành dầu khí, các nhà máy lọc dầu, nhà máy
hóa dầu và tàu chở dầu biển.
+ Ngoài ra, nó còn làm mát các lò phản ứng chứa đầy chất xúc tác trong quá trình bảo trì.
7. Một số hợp chất của Nitrogen
*Amoniac NH3
- Là chất khí không màu, có mùi khai xốc, nhẹ hơn không khí, tan rất nhiều trong nước.
- Sản xuất axit nitric, các loại phân đạm như ure (NH2)2CO; NH4NO3; (NH4)2SO4…
- Amoni lỏng dùng để làm lạnh trong máy lạnh.
- NH3 là nguyên liệu để điều chế hidrazin (N2H4)
* Muối amoni
- Công thức tổng quát : (NH4)nA, là muối của NH3 với axit bất kì
- Muối amoni chất điện ly mạnh, tan tốt trong nước. Khi tan chúng điện ly hoàn toàn thành các ion.
- Phương pháp nhận biết muối amoni: Khi cho tác dụng với dung dịch kiềm tạo ra khí amoniac có mùi khai
* Axit nitric HNO3
- Tồn tại ở dạng chất lỏng hoặc khí, không màu, tan nhanh trong nước, tính ăn mòn cao, dễ bắt lửa và cực độc.
- Hợp chất này trong tự nhiên sẽ có màu vàng nhạt do sự tích tụ của oxit nitơ.
- Axit nitric 68% được sử dụng để chế tạo thuốc nổ bao gồm trinitrotoluen (TNT), nitroglycerin, cyclotrimethylenetrinitramin (RDX)
- Sản xuất các loại phân bón chứa nitơ như phân đạm nitrat amoni NH4NO3, các muối nitrat như Ca(CO3)2, KNO3,...
- Axit nitric nồng độ 86% khi để ngoài không khí sẽ có hiện tượng khói trắng bốc lên.
8. Sơ đồ tư duy về Nitrogen
9. Một số câu hỏi về Nitrogen và hợp chất của Nitrogen
Câu 1: Hiện tượng nào xảy ra khi dãn khí NH3 đi qua ống đựng bột CuO nung nóng
A. bột Cuo từ màu đen sang màu trắng
B. bột Cuo từ màu đen sang màu đỏ, có hơi nước ngưng tụ
C. bột CuO từ màu đen sang màu xanh, có hơi nước ngưng tụ
D. bột Cuo không đổi màu.
Câu 2: Ở nhiệt độ thường, khá trơ về mặt hóa học. Nguyên nhân là do:
A. Trong phân tử N2 có liên kết ba rất bền
B. Trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết
C. Nguyên tử nitơ có độ âm điện kém hơn oxi
D. Nguyên tử nitơ có bán kính nhỏ
Câu 3: Hỗn hợp gỗm N2 và H2 trong bình phản ứng ở nhiệt độ không đổi. Sau thời gian phản ứng, áp suất các khí trong bình thay đổi 5%
so với áp suất ban đầu. Biết rằng số mol N2 đã phản ứng là 10%. Thành phần phần trăm số mol N2 trong hỗn hợp ban đầu là:
A. 20%
B. 25%
C. 10%
D. 5%
Câu 4: Phần trăm khối lượng của N trong một oxit của nó là 30,43%.Tỉ khối của A so với He bằng 23. Xác định CTPT của oxit đó là:
A. N2O
B. N2O4
C. N2O5
D. NO2
Câu 5: Cho 4 lít N2 và 14 lít H2 vào bình phản ứng, hỗn hợp thu được sau phản ứng có thể tích bằng 16,4 lít (các thể tích khí được đo
trong cùng điều kiện). Hiệu suất phản ứng là bao nhiêu?





