

Silic | Si (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Silic (Si) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Silic (Si): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
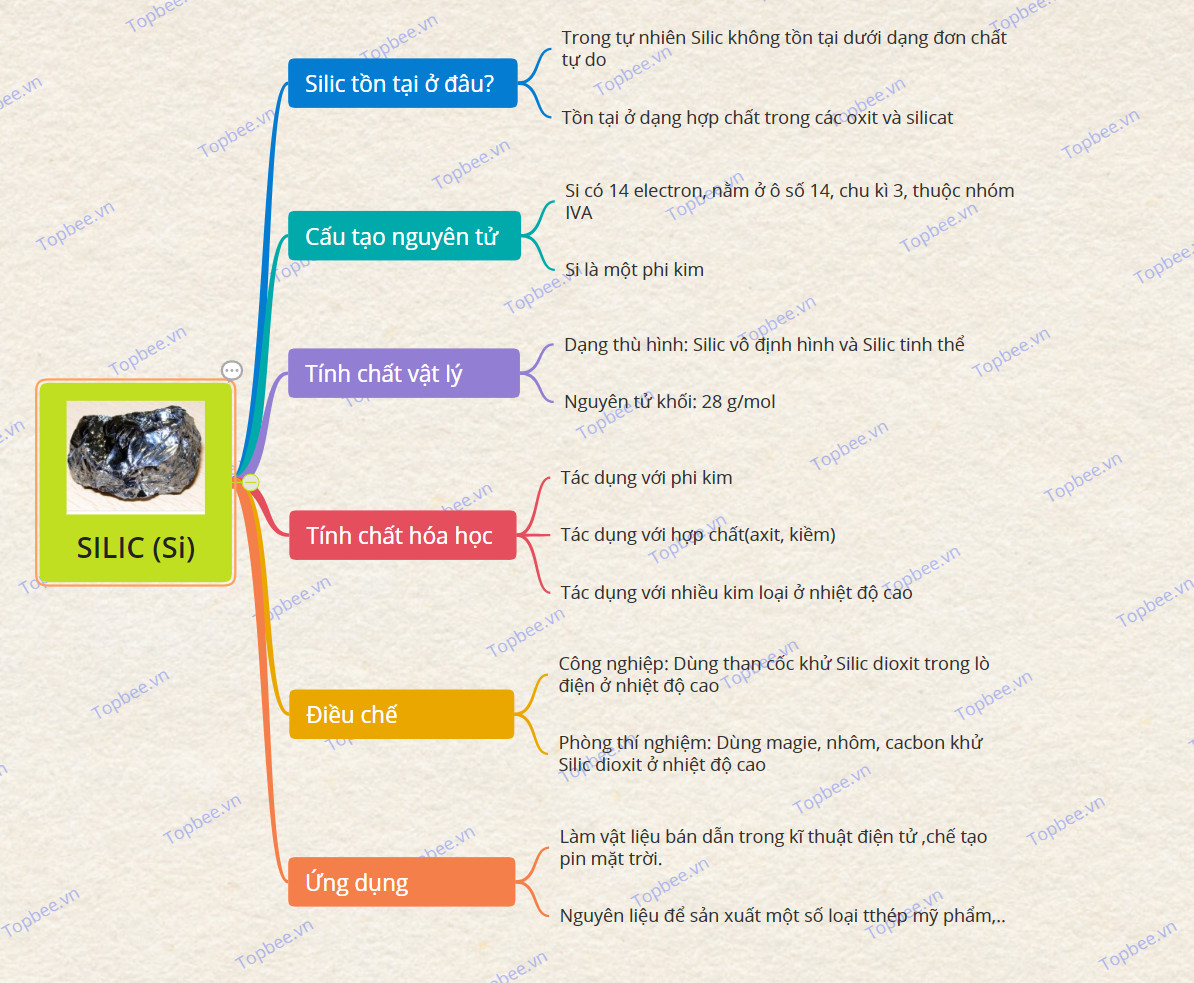
Silic tồn tại ở đâu?
- Silic là nguyên tố hóa học kí hiệu là Si và có số hiệu nguyên tử là 14 trong bảng tuần hoàn hóa học.
- Theo khối lượng, Silic chiếm 29,5% vỏ Trái Đất, là nguyên tố phổ biến thứ hai sau oxi.
- Trong tự nhiên Silic không tồn tại dưới dạng đơn chất tự do.
- Si tồn tại ở dạng hợp chất trong các oxit và silicat.
Cấu tạo nguyên tử
+ Cấu hình e nguyên tử của Silic: 1s22s22p63s23p2.
Viết gọn [Ne]3s23p2.
+ Nguyên tố Si có 14 electron, nằm ở ô số 14, chu kì 3, thuộc nhóm IVA
+ Silic là một phi kim.
Tính chất vật lý
+ Silic là phi kim hoạt động hóa học yếu hơn Carbon và Clo.
+ Dạng thù hình chính: Silic vô định hình và Silic tinh thể
- Silic vô định hình:
+ Là chất bột màu nâu, không kết tinh của Silic
+ Không tan trong nước nhưng tan trong kim loại nóng chảy.
- Silic tinh thể:
+ Là một chất kết tinh màu xám đen, ánh kim.
+ Mạng cấu trúc tinh thể Silic giống với kim cương nên nó có tính bán dẫn.
- Silic vô định hình có khả năng phản ứng mạnh mẽ hơn Silic tinh thể.
- Nhiệt độ nóng chảy: 1414ºC
- Nhiệt độ sôi :2349ºC.
- Silic trong suốt đối với bức xạ hồng ngoại bắt đầu ở bước sóng 1,1 micromet.
Tính chất hóa học
- Silic có các mức độ oxi hóa đa dạng: 4; 0; + 2; + 4. Do đó Si vừa có cả tính khử và vừa có tính oxi hoá.
* Tính khử
a. Tác dụng với phi kim:
Si + 2F2 → SiF4 (phản ứng xảy ra ở nhiệt độ thường)]
Si + 2O2 → SiO2 (400 - 6000C)
b. Tác dụng với hợp chất:
- Si tan dễ dàng trong dung dịch kiềm giải phóng hidro
Si + 2NaOH + H2O → Na2SiO3 + 2H2
- Si tác dụng với axit
4HNO3 + 18HF + 3Si → 3H2SiF6 + 4NO + 8H2O
* Tính oxi hóa
- Si tác dụng được với nhiều kim loại ở nhiệt độ cao → silixua kim loại.
2Mg + Si → Mg2Si
- Silic không oxi hóa được H2 như Cacbon nhưng có thể khử một số chất có tính oxi hóa mạnh như HNO3 hay H2SO4 (đặc nóng).
Điều chế
*Trong phòng thí nghiệp: Khử Silic đioxit bằng các chất khử mạnh mẽ như magie, nhôm, cacbon ở nhiệt độ cao:
SiO2 + 2Mg → 2MgO + Si (có thể thay Mg bằng Al)
SiO2 + C (Than cốc) → 2CO + Si (18000C)
*Trong công nghiệp: Silic được sản xuất bằng cách dùng than cốc khử Silic đioxit trong lò điện ở nhiệt độ cao
Phản ứng xảy ra theo công thức:
SiO2 + 2C → Si + 2CO
Sản phẩm tạo ra: Silic (Si) và khí cacbon monoxit (CO).
Ứng dụng
Silic đa dạng ứng dụng trong cuộc sống và trong nhiều ngành công nghiệp:
+ Silic được dùng làm vật liệu bán dẫn trong kĩ thuật điện tử và được dùng để chế tạo pin mặt trời, sản xuất một số loại thép,..
+ Hợp chất của Silic là Canxi silicat và canxialuminat là nguyên liệu chính trong công nghiệp sản xuất xi măng.
+ Dùng Si trong sản xuất sản phẩm chống cháy: bồn gốm chống cháy, vải chống cháy và các vật liệu cách nhiệt khác.
+ Gạch ngói, gạch chịu lửa, sành sứ,.. có nguyên liệu chính là đất sét, thạch anh và fenpat(là oxit của silic , natrium, kalium,…)
+ Sản xuất đồng thau bao gồm hợp kim của đồng với Silic .
+ Thành phần chính để sản xuất thủy tinh gồm hỗn hợp của natri Silica và canxi Silicat.
+ Silic được sử dụng trong sản xuất mỹ phẩm và sản phẩm chăm sóc cá nhân như mỹ phẩm phấn mịn, kem đánh
răng và nhiều loại mỹ phẩm khác.
Một số hợp chất
*Silic dioxit: SiO2
- Tồn tại dưới dạng tinh thể nguyên tử
- Không tan trong nước nhưng dễ tan trong axit HF(dùng khắc chữ lên thủy tinh).
- Trong các khoáng vật thạch anh có mặt của silic dioxit
* Axit silixic: H2SiO3
- Là axit yếu, dạng keo, không tan trong nước, khi đun nóng dễ bị mất nước.
- H2SiO3 sấy khô sẽ tạo thành vật liệu xốp là silicagen được dùng làm chất hút ẩm và hấp phụ nhiều chất.
*Muối silicat:
- Là muối của axit silixic thường không màu, khó tan (trừ muối kim loại kiềm tan được).
- Muối silicat natri: Na2SiO3(silicat vôi)
+ Khả năng chống ăn mòn, chống rỉ sét cao
+ Được ứng dụng trong sản xuất xà phòng, chất tẩy rửa
+ Dung dịch Na2SiO3 đậm đặc là thủy tinh lỏng dùng trong sản xuất keo dán thủy tinh và sứ…
- Muối silicat canxi: CaSiO3
+ Tồn tại trong các khoáng vật thạch anh, hồng thạch anh, thạch anh tím,..
+ Ứng dụng trong sản xuất xi măng, vật liệu xây dựng.
Sơ đồ tư duy về Silic
Một số câu hỏi về Silic và hợp chất của Silic
Câu 1: Si tác dụng với chất nào sau đây ở nhiệt độ thường?
A. F2
B. O2
C. H2
D. Mg
Câu 2: Hãy nêu một số đặc điểm của nguyên tố Silic về trạng thái tự nhiên, tính chất và ứng dụng.
Câu 3: Công nghiệp silicat là ngành công nghiệp chế biến các hợp chất của silic. Ngành sản xuất nào sau đây không thuộc ngành công
nghiệp slicat?
A. Sản xuất xi măng
B. Sản xuất đồ gốm
C. Sản xuất thủy tinh hữu cơ
D. Sản xuất thủy tinh
Câu 4: Các phát biểu nào sau đây về nguyên tố silic và hợp chất của silic không đúng:
A. Si tinh thể có cấu trúc giống kim cương, có tính bán dẫn, còn Si vô định hình là chất bột màu nâu
B. Si là nguyên tố phổ biến thứ 2 sau oxi trong vỏ Trái đất
C. Silicagen là muối kim loại kiềm của axit H2SiO3 có tác dụng hút ẩm và hấp phụ nhiều chất.
D. Silic siêu tinh khiết được dùng làm chất bán dẫn
Câu 5: Một hợp chất gồm 2 nguyên tố Silic và Hidro có phân tử khối là 32 đvC. Tìm công thức hóa học của hợp chất đó





