

Thiếc | Sn (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Thiếc (Sn) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Thiếc (Sn): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
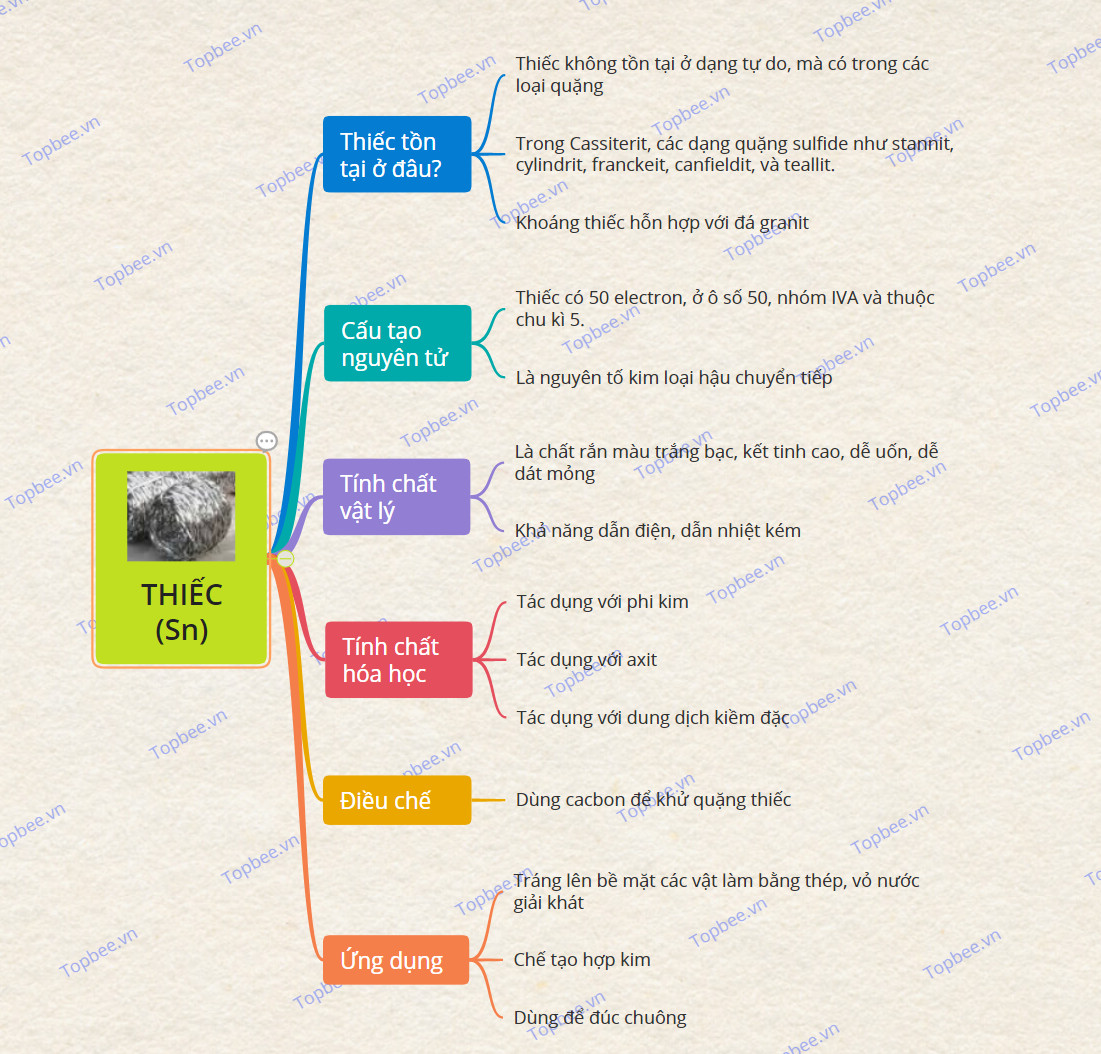
Thiếc tồn tại ở đâu?
- Thiếc là nguyên tố hóa học có kí hiệu là Sn và có số hiệu nguyên tử là 50 trong bảng tuần hoàn các nguyên tố hóa học.
- Trong tự nhiên, Thiếc không ở dạng tự do, mà tồn tại trong các loại quặng:
+ Cassiterit (SnO2) , các dạng quặng sulfide như stannit, cylindrit, franckeit, canfieldit, và teallit.
+ Các khoáng thiếc hỗn hợp với đá granit (1% hàm lượng thiếc oxide).
Cấu tạo nguyên tử
+ Cấu hình electron: [Kr]4d105s25p2
+ Nguyên tử Thiếc có 50 electron, ở ô số 50, nhóm IVA và thuộc chu kì 5.
+ Thiếc là nguyên tố kim loại hậu chuyển tiếp
+ Đồng vị: 115Sn, 119Sn và 117Sn
Tính chất vật lý
+ Là chất rắn màu trắng bạc, kết tinh cao, dễ uốn, dễ dát mỏng.
+ Khả năng dẫn điện, dẫn nhiệt kém hơn các kim loại chuyển tiếp khác
+ Hai dạng thù hình: thiếc trắng và thiếc xám
+ Khối lượng nguyên tử: 9 g/mol.
+ Khối lượng riêng lớn D = 7,92 g/cm3.
+ Nhiệt độ nóng chảy: 505,08 K (231,93°C, 449,47°F)
+ Nhiệt độ sôi: 2875 K (2602°C, 4716°F)
Tính chất hóa học
- Thiếc là kim loại có tính khử yếu hơn kẽm và niken.
- Thiếc có tính chống ăn mòn từ nước nhưng dễ hòa tan bởi axit và bazơ
thể hiện tính lưỡng tính.
* Tác dụng với phi kim
- Tác dụng với oxi:
+ Trong không khí, Sn không bị oxi hóa.
+ Bị oxi hóa thành SnO2 ở nhiệt độ cao.
Sn + O2 → SnO2
- Tác dụng với halogen.
Ví dụ:
Sn + 2Cl2 → SnCl4
* Tác dụng với axit
- Thiếc tác dụng chậm với với dung dịch HCl và H2SO4 loãng tạo thành muối Sn (II) và hidro.
Sn + H2SO4 → SnSO4 + H2
- Với H2SO4 và HNO3 đặc tạo thành hợp chất Sn (IV)
Sn + 2H2SO4(đặc) → SnO2 + 2SO2 + 2H2O.
Sn + 4HNO3 (đặc) → SnO2 + 4NO2 + 2H2O.
4Sn + 10HNO3 (rất loãng) → 4Sn(NO3)2 + NH4NO3 + 3H2O.
* Tác dụng với dung dịch kiềm đặc
Sn + NaOH (đặc, nguội) + 2H2O → Na[Sn(OH)3 ] + H2
Sn + 2NaOH (đặc) + 4H2O → Na2 [Sn(OH)6] + 2H
Điều chế
Phương pháp điều chế: Dùng cacbon để khử quặng thiếc:
SnO2 + 2C → Sn + 2CO
Ứng dụng
+ Thiếc dùng để tráng lên bề mặt các vật làm bằng thép, vỏ nước giải khát, vỏ đựng thực phẩm;
+ Chế tạo hợp kim từ thiếc, trục ổ quay, các vật dụng gia đình,…
+ Thiếc hàn có khả năng chống ăn mòn
+ Ứng dụng tạo hợp kim như chất hàn chì, hộp thiếc, đồng thiếc, thiếc hàn asahi...
+ Dùng để đúc chuông (kim loại thiếc và đồng thiếc);
+ Thiếc phế liệu được để tái chế và tận dụng làm ra những vật dụng khác nhau
Một số hợp chất
* Thiếc (II) clorua: SnCl2
+Là chất rắn dạng tinh thể màu trắng
+ Bền ở dạng ngậm hai phân tử nước nhưng dễ thủy phân trong nước nóng.
+ SnCl2 dùng làm chất khử trong dung dịch axit
+ Sử dụng Thiếc II clorua trong bể điện phân để mạ thiếc.
* Thiếc (IV) oxit: SnO2
+ Oxit thiếc rất trắng, tỷ trọng cao, là oxit cao nhất của thiếc kim loại.
+ Thiếc IV oxit dùng làm chất mờ đục với hàm lượng từ 5 - 15% cho các loại men
* Thiếc (II) sunfat: SnSO4
+ Là một chất rắn màu trắng, tan được trong nước.
+ Bị thủy phân ở nhiệt độ cao thành SnO2 và SO2.
+ Thiếc (II) sunfat là nguồn ion thiếc (II) tinh khiết, không bị nhiễm các loại thiếc (IV).
Sơ đồ tư duy về Thiếc
Một số câu hỏi về Thiếc và hợp chất của Thiếc
Câu 1: Sắt tây là sắt được phủ lên bề mặt bởi kim loại nào sau đây ?
A. Zn
B. Ni
C. Sn
D. Cr.
Câu 2: Hòa tan hoàn toàn m gam hỗn hợp E gồm Sn và một kim loại R (có hóa trị không đổi) trong lượng dư dung dịch HCl, thu được
5,04 lít khí H2 (đktc) và dung dịch chứa 36,27 gam muối. Mặt khác, để đốt cháy cũng m gam hỗn hợp E cần vừa đủ 3,696 lít O2 (đktc).
Kim loại R là?
Câu 3: Thiếc được điều chế tốt nhất bằng phương pháp nào sau đây?
A. Phương pháp thủy luyện.
B. Phương pháp nhiệt luyện.
C. Phương pháp điện phân nóng chảy.
D. Phương pháp điện phân dung dịch.
Câu 4: Tìm phát biểu đúng về Thiếc?
A. Thiếc không tan trong dung dịch kiềm đặc.
B. Thiếc là kim loại có tính khử mạnh.
C. Trong tự nhiên, thiếc được bảo vệ bằng lớp màng oxit nên tương đối trơ về mặt hóa học.
D. Trong mọi hợp chất, thiếc đều có số oxi hóa +2.
Câu 5: Cho các phản ứng sau:
Sn + O2 (t°)→
Sn + HNO3 loãng →
Sn + NaOH đặc →
Sn + H2SO4 đặc →
Số phản ứng luôn tạo ra sản phẩm chứa Sn ở số oxi hóa +4 là
A. 1.
B. 2.
C. 3.
D. 4.





