

Thủy ngân | Hg (CTCT, Tính chất vật lí, hóa học, Điều chế, Mindmap)
 26/12/2023
26/12/2023
Bài viết tìm hiểu về Thủy ngân (Hg) do Topbee biên soạn tổng hợp kiến thức trọng tâm về Thủy ngân (Hg): Công thức hóa học, Tính chất vật lí, hóa học, Điều chế, Mindmap giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học.
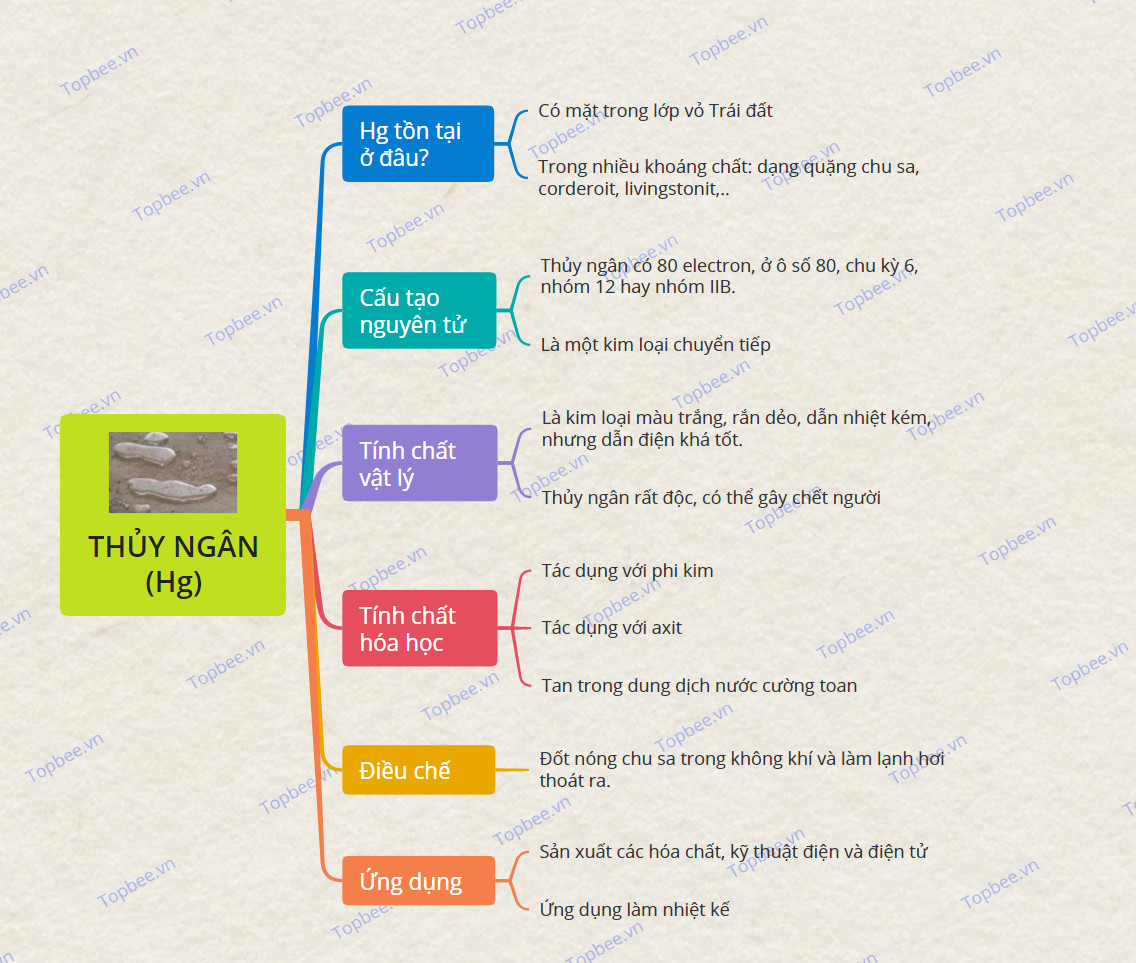
Thủy ngân tồn tại ở đâu?
+ Thủy ngân là nguyên tố hóa học có ký hiệu Hg và số hiệu nguyên tử 80 trong bảng tuần hoàn hóa học.
+ Có mặt trong lớp vỏ Trái đất, giải phóng ra môi trường từ hoạt động của núi lửa, quá trình phong hóa đá và tác động của con người.
+ Thủy Ngân tồn tại trong nhiều khoáng chất khác nhau như dạng quặng chu sa - Thủy Ngân (II) Sunfit (HgS) hay corderoit, livingstonit,..
+ Thủy ngân có thể có trong nước và các loại thực phẩm bị ô nhiễm.
Cấu tạo nguyên tử
+ Cấu hình e của Hg là: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2
Viết gọn: [Xe] 4f14 5d10 6s2.
+ Nguyên tố Thủy ngân có 80 electron, ở ô số 80, chu kỳ 6 và thuộc nhóm 12 hay nhóm IIB.
+ Là một kim loại chuyển tiếp nằm giữa nhóm IIA và IIIA trong bảng tuần hoàn .
+ Hóa trị thường là +1 và + 2.
+ Trong hợp chất, Hg thường có hướng nhường e nên tạo thành ion H+1 và H+2.
Tính chất vật lý
- Là kim loại màu trắng, ở trạng thái rắn dẻo, dẫn nhiệt kém, nhưng dẫn điện khá tốt.
- Hg là nguyên tố kim loại duy nhất ở dạng lỏng ở nhiệt độ thường.
- Thủy ngân rất độc, có thể gây chết người khi bị nhiễm độc qua đường hô hấp.
- Nguyên tử khối: 201 g/mol
- Khối lượng riêng: 13,546 g/cm3
- Nhiệt độ nóng chảy: -38,8620C
- Nhiệt độ sôi: 356,660C.
Tính chất hóa học
Thủy Ngân (Hg) là kim loại có tính khử yếu, nó có khả năng xảy ra phản ứng hóa học với phi kim và dung dịch axit.
*Thủy Ngân tác dụng với phi kim
+ Hg có thể xảy ra phản ứng hóa học với một số phi kim như oxi hoặc các nguyên tố thuộc nhóm Halogen ở điều kiện nhiệt độ cao.
Hg + S → HgS
2Hg + O2 → 2HgO
Hg + Cl2 → HgCl2
+ Thủy ngân tác dụng với Lưu huỳnh ở nhiệt độ thường, được ứng dụng trong việc thu hồi Thủy ngân.
*Tác dụng với dung dịch axit:
+ Thủy ngân chỉ xảy ra phản ứng với các dung dịch axit có tính oxi hóa mạnh ở trạng thái đặc, nóng.
2Hg + 2H2SO4 (đặc, nóng) → Hg2SO4 + SO2 + 2H2O
Hg + 4HNO3 (đặc, nóng) → Hg(NO3)2 + 2NO2 + 2H2O
*Thủy ngân còn có khả năng tan trong nước cường toan:
3Hg + 2HNO3 (đặc) + 6HCl (đặc) → 3HgCl2 + 2NO + 4H2O
+ Lưu ý: Hg tạo ra các hỗn hống (lỏng hoặc rắn) với nhiều kim loại như K, Ca, Ba, Cu, Na, Ag, Au, Cd, Pd, Zn,... (hỗn hống là một
hợp chất giữa kim loại hoặc hợp kim với nhau).
Điều chế
- Phương pháp: Đốt nóng chu sa trong luồng không khí và làm lạnh hơi thoát ra.
HgS + O2 → Hg + SO2
Ứng dụng
+ Thủy ngân được sử dụng trong sản xuất các hóa chất, trong kỹ thuật điện và điện tử, trong một số nhiệt kế.
+ Thiomersal là chất khử trùng trong vắc-xin và mực xăm (Thimerosal in vaccines).
+ Ứng dụng trong các thiết bị: Phong vũ kế thủy ngân, bơm khuếch tán, tích điện kế thủy ngân và nhiều thiết bị phòng thí nghiệm khác.
+ Hg được sử dụng để làm kín các chi tiết chuyển động của máy khuấy dùng trong kỹ thuật hóa học.
+ Điểm ba trạng thái của thủy ngân - 38,8344 °C, là điểm cố định được sử dụng như nhiệt độ tiêu chuẩn cho thang đo nhiệt độ quốc tế
(ITS-90).
+ Hơi thủy ngân được dùng trong đèn hơi thủy ngân, một số đèn kiểu "đèn huỳnh quang"
+ Tách vàng và bạc trong các quặng sa khoáng bằng thủy ngân.
Một số hợp chất
*Thủy ngân II Clorua: HgCl2.
+ Là một chất rắn tinh thể màu trắng, có độc tính cao và có hại khi tiếp xúc với cơ thể người.
+ Dùng làm chất thử trong phòng thí nghiệm
+ Ứng dụng chính là làm chất xúc tác cho quá trình acetylen (C2H2) biến đổi thành vinyl clorua (C2H3Cl), tiền thân của polyvinyl clorua.
*Thủy ngân II nitrat: HgNO3
+ Là một muối tinh thể không màu và có độc, tan trong nước của thủy ngân(II) và axit nitric
+ Điều chế bằng phản ứng giữa thủy ngân và axit nitric nóng đậm đặc
+ Thủy ngân(II) nitrat được sử dụng trong các phản ứng thủy ngân hóa, các phản ứng liên quan đến ketone
Sơ đồ tư duy về Thủy ngân
Một số câu hỏi về Thủy ngân và hợp chất của Thủy ngân
Câu 1: Biết 4g thủy ngân (Hg) kết hợp với clo tạo ra 5,42g thủy ngân clorua. Em hãy cho biết công thức hóa học đơn giản của thủy ngân
clorua. Cho biết MHg = 201.
Câu 2: Viết phương trình hóa học của phản ứng hiđro khử các oxit : Thủy ngân (II) oxit.
Câu 3: Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp
theo quan sát được là?
Câu 4: Tại sao khi đánh rơi vỡ nhiệt kế thủy ngân thì không được dùng chổi quét mà nên rắc bột S lên trên?
Câu 5: Chất phản ứng với thủy ngân ở điều kiện thường là? Viết phương trình phản ứng xảy ra.





