

Bảng tuần hoàn các nguyên tố hóa học mới
 31/1/2024
31/1/2024
Tổng hợp kiến thức về Bảng tuần hoàn các nguyên tố Hóa học: cách gọi tên các nguyên tố hóa học theo danh pháp quốc tế (IUPAC), bảng nguyên tử khối, bảng hoá trị để có thể ghi nhớ các nguyên tố dễ dàng giúp học sinh học tốt môn Hóa học
Nguồn gốc bảng tuần hoàn hóa học
- Là một phương pháp liệt kê các nguyên tố hóa học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng.
- Năm 1860, giáo sư trường đại học Peterbourg là Mendeleev (1834 - 1907) đã tiến hành nghiên cứu việc phân loại các nguyên tố. Cuối cùng Mendeleev đã phát hiện ra sự thay đổi tuần hoàn tính chất các nguyên tố theo khối lượng nguyên tử (thời đó người ta gọi là nguyên tử lượng) của chúng. Ông sắp xếp 63 nguyên tố hóa học đã được phát hiện vào thời kỳ đó vào bảng tuần hoàn các nguyên tố. Vào năm 1869 Mendeleev chính thức công bố bảng hệ thống tuần hoàn các nguyên tố.
- Bố cục của bảng tuần hoàn hóa học ngày nay đã được tinh chỉnh và mở rộng dần theo thời gian khi mà các nguyên tố dần được phát hiện.
Hình ảnh bảng tuần hòa hóa học mới
Một số hình ảnh về bảng tuần hoàn hóa học hiện nay:
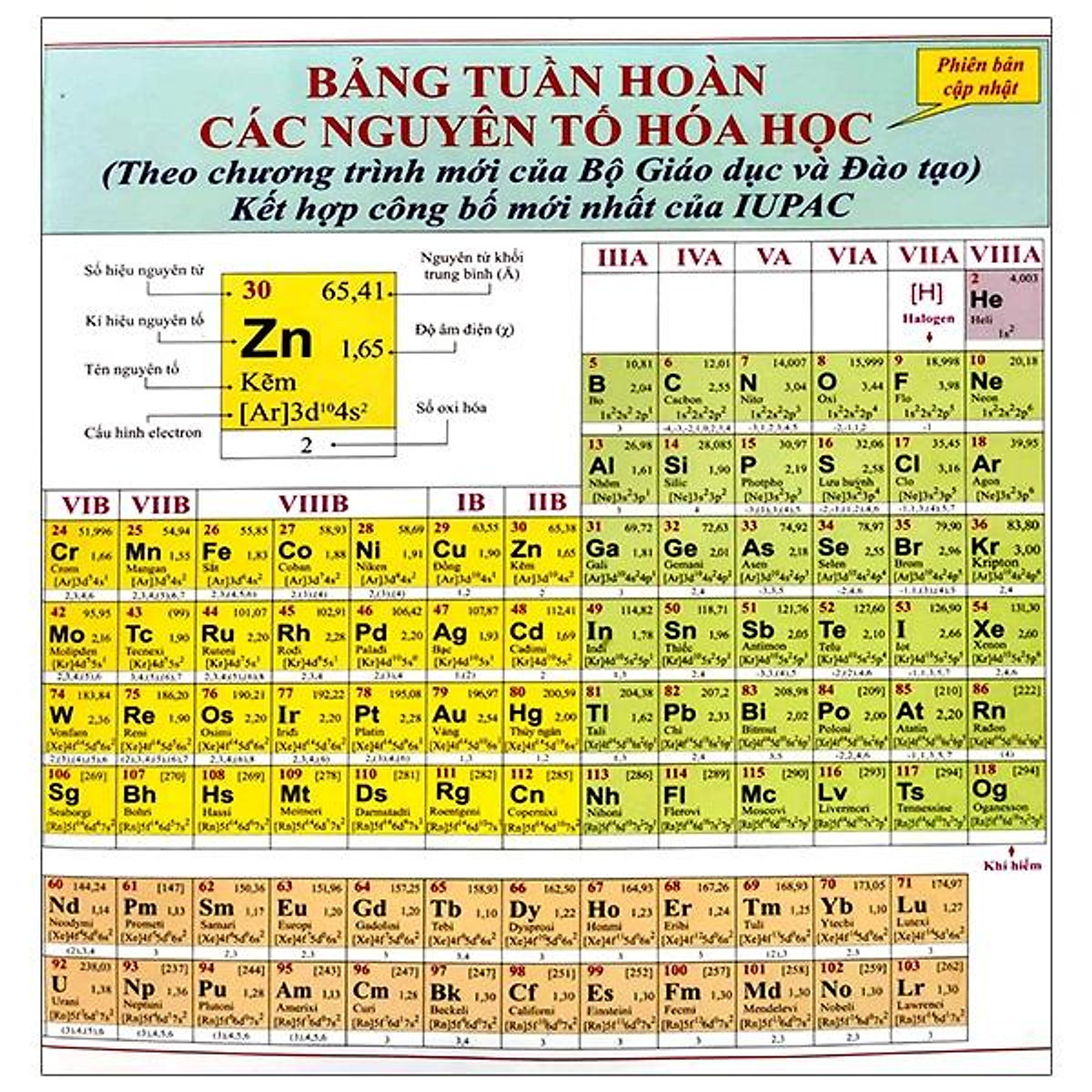


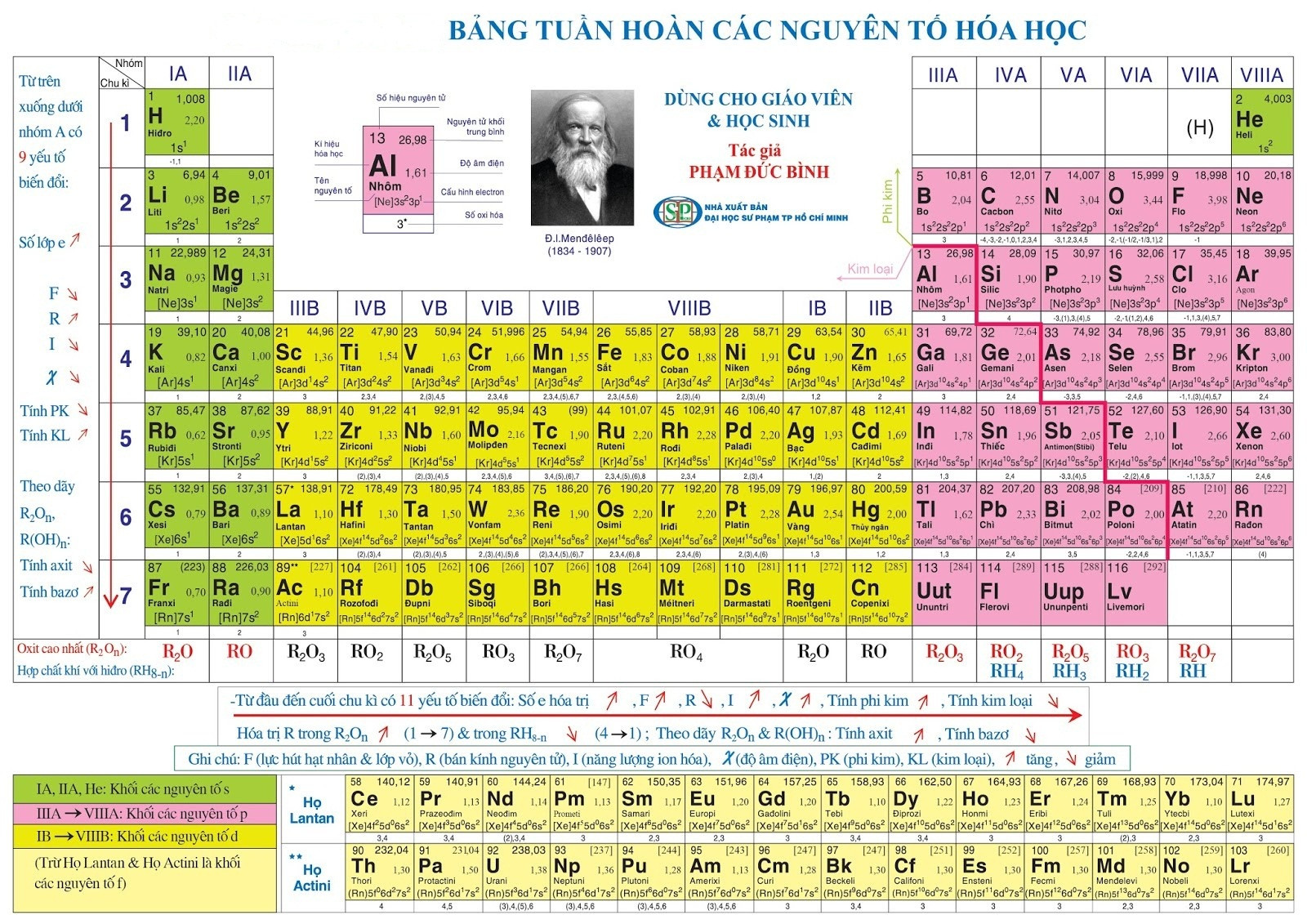

Bảng tuần hoàn hóa học mới có bao nhiêu nguyên tố
Bảng tuần hoàn hóa học có 118 nguyên tố, gồm các nguyên tố từ 1(Hidro) đến 118 (Oganesson).
Bảng tuần hoàn hóa học được sắp xếp như thế nào?
*Nguyên tắc sắp xếp các nguyên tố
- Các nguyên tố trong bảng tuần hoàn được xếp theo chiều tăng dần của điện tích hạt nhân (từ trái sang phải, từ trên xuống dưới)
- Các nguyên tố có cùng số lớp e xếp vào cùng một hàng (chu kì).
- Các nguyên tố có cấu hình e tương tự nhau được xếp vào cùng một cột (nhóm).
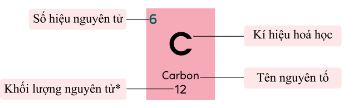
a) Ô nguyên tố
- Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân)
b) Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
* Chu kì nhỏ: gồm chu kì 1, 2, 3.
* Chu kì lớn: gồm chu kì 4, 5, 6, 7.
Ví dụ: 12Mg: 1s22s22p63s2.
→ Mg thuộc chu kì 3 vì có 3 lớp electron.
c) Nhóm nguyên tố
- Là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, có tính chất hóa học gần giống nhau và được xếp thành một cột.
*Có 2 loại nhóm nguyên tố:
Nhóm A:
- Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
- Bao gồm các nguyên tố s và p.
Nhóm B:
- bao gồm các nguyên tố d và f
+ Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
+ Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
+ Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
*Khối các nguyên tố s, p, d, f
- Khối các nguyên tố s: Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
+ Gồm các nguyên tố nhóm IA và IIA
+ Ví dụ: 11Na: 1s22s22p63s1
- Khối các nguyên tố p: Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
+ Gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He).
+ Ví dụ: 13Al: 1s22s22p63s23p1
- Khối các nguyên tố d: Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
+ Gồm các nguyên tố thuộc nhóm B.
+ Ví dụ: 26Fe: 1s22s22p63s23p63d64s2
- Khối các nguyên tố f: Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
+ Gồm các nguyên tố thuộc họ Lantan và họ Actini.
Ví dụ: 58Ce: 1s22s22p63s23p63d104s24p64f25s25p66s2
Cách đọc bảng tuần hoàn hóa học
- Số nguyên tử: Là số điện tích của hạt nhân
+ Số nguyên tử hay số proton của 1 nguyên tố hóa học là số proton được tìm thấy trong hạt nhân của 1 nguyên tử.
+ Số nguyên tử giúp xác định duy nhất một nguyên tố hóa học.
+ Trong một nguyên tử không tích điện, số nguyên tử cũng bằng số electron.
- Tên nguyên tố: Nguyên tố hóa học là 1 chất hóa học tinh khiết, bao gồm 1 kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong mỗi hạt nhân
- Ký hiệu hóa học: Là tên viết tắt của một nguyên tố hóa học: thường bao gồm 1 hoặc 2 chữ cái trong bảng chữ cái Latinh và được viết với chữ cái đầu tiên viết hoa.
- Nguyên tử khối: Là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử tương ứng.
- Độ âm điện:
+ Là khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
+ Độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim nguyên tố đó càng mạnh và ngược lại, độ âm điện của nguyên tử nguyên tố càng nhỏ thì tính kim loại càng mạnh
- Cấu hình Electron: Cho biết sự phân bố các electron trong lớp vỏ nguyên tử ở các trạng thái năng lượng khác nhau hay ở các vùng hiện diện của chúng
- Số Oxi hóa: có thể nhận biết được số electron được trao đổi khi một chất bị oxi hóa hoặc bị khử trong một phản ứng
Cách ghi nhớ các nguyên tố trong bảng tuần hoàn hóa học
- Nhận biết các thành phần của mỗi nguyên tố: Tên nguyên tố, ký hiệu hóa học, số hiệu nguyên tử, nguyên tử khối đều nằm trong ô nguyên tố trong bảng tuần hoàn
- Học vài nguyên tố mỗi ngày:
+ Bắt đầu học mười nguyên tố đầu tiên.
+ Sau khi bạn đã thông thạo thì hãy học mười nguyên tố kế tiếp.
+ Thường xuyên ôn lại các nguyên tố cũ trong khi học nguyên tố mới.
- In ra một bảng tuần hoàn: In ra nhiều bản, đặt một bản trên bàn học, một bản trong ba lô hoặc trong ví, và luôn mang theo bản còn lại.
- Làm thẻ ghi chú cho mỗi nguyên tố:
+ Một mặt viết ký hiệu nguyên tố như Ag, S hay Cu cùng với số hiệu nguyên tử.
+ Mặt kia viết tên nguyên tố như bạc, lưu huỳnh hay đồng.
- Chia bảng tuần hoàn thành những phần nhỏ hơn: Chia theo hàng, cột, trọng lượng nguyên tử hoặc đơn giản là từ dễ đến khó.
- Học thuộc bài hát bảng tuần hoàn: Tự sáng tác bài hát cho riêng mình hoặc tìm một bài trên internet.





